Hỗ trợ tư vấn
Tư vấn - Giải đáp - Hỗ trợ đặt tài liệu
Mua gói Pro để tải file trên Download.vn (không bao gồm tài liệu cao cấp) và trải nghiệm website không quảng cáo
Tìm hiểu thêm »Đề thi giữa kì 1 Khoa học tự nhiên 8 Cánh diều năm 2025 - 2026 gồm 4 đề có đáp án giải chi tiết kèm theo bảng ma trận, đặc tả đề thi. Qua đề kiểm tra giữa kì 1 Khoa học tự nhiên 8 Cánh diều giúp các bạn học sinh ôn luyện củng cố kiến thức để biết cách ôn tập đạt kết quả cao.
TOP 4 Đề kiểm tra giữa kì 1 Khoa học tự nhiên 8 Cánh diều năm 2025 được biên soạn dưới dạng file Word với cấu trúc mới theo Công văn 7991 gồm trắc nghiệm lựa chọn đáp án đúng, đúng sai, trả lời ngắn và tự luận. Hi vọng qua đề kiểm tra giữa kì 1 Khoa học tự nhiên 8 Cánh diều sẽ giúp các em học sinh nắm vững kiến thức, kỹ năng toán học đã học trong nửa đầu học kì, làm quen với áp lực thời gian, cách phân bổ thời gian hợp lý, trình bày bài thi rõ ràng, mạch lạc. Bên cạnh đó các bạn xem thêm: bộ đề thi giữa học kì 1 Ngữ văn 8 Cánh diều, đề thi giữa học kì 1 môn Toán 8 Cánh diều.
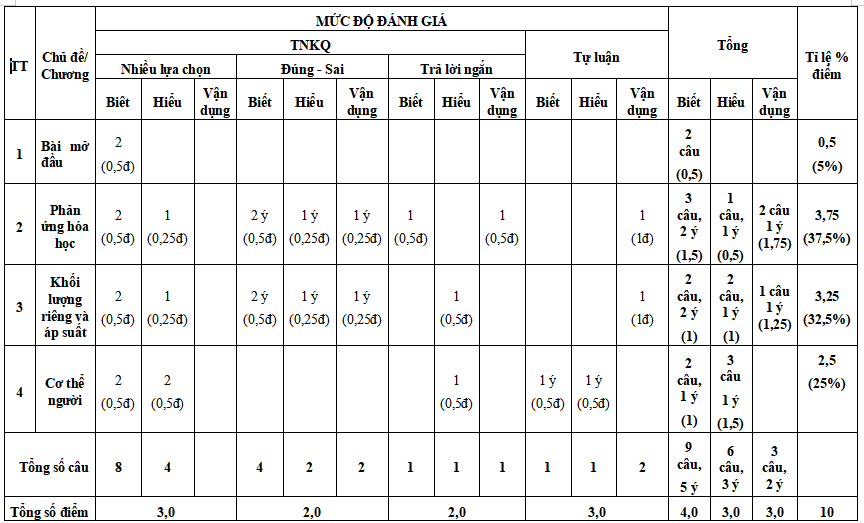
............
Xem đầy đủ ma trận đề thi trong file tải về
|
UBND PHƯỜNG .... TRƯỜNG THCS....
|
ĐỀ KIỂM TRA GIỮA HỌC KÌ 1 NĂM HỌC 2025-2026 Môn: KHTN LỚP 8 Thời gian làm bài: 60 phút |
PHẦN I. TRẮC NGHIỆM NHIỀU LỰA CHỌN (3 điểm)
Câu 1: Vôn kế dùng để đo
A. Cường độ dòng điện
B. Hiệu điện thế
C. Công suất mạch điện
D. Giá trị điện trở
Câu 2: Cơ quan nào sau đây thuộc hệ hô hấp ở người?
A. Tim.
B. Phổi.
C. Thận.
D. Dạ dày.
Câu 3: Khi phản ứng hóa học xảy ra, yếu tố thay đổi là
A. khối lượng các nguyên tử.
B. số lượng các nguyên tử.
C. liên kết giữa các nguyên tử.
D. thành phần các nguyên tố.
Câu 4: Thao tác nào sau đây là đúng khi sử dụng hoá chất?
A. Ngửi, nếm hóa chất.
B. Sử dụng tay tiếp xúc trực tiếp với hóa chất.
C. Sau khi lấy hóa chất xong cần phải đậy kín các lọ đựng hóa chất.
D. Đổ hóa chất trực tiếp vào cống thoát nước hoặc đổ ra môi trường.
Câu 5: Hiện tượng nào sau đây xảy ra đối với khối lượng riêng của nước khi đun nước trong một bình thủy tinh?
A. Khối lượng riêng của nước tăng.
B. Khối lượng riêng của nước giảm.
C. Khối lượng riêng của nước không thay đổi.
D. Khối lượng riêng của nước lúc đầu giảm sau đó mới tăng.
Câu 6: Xương có nhiều biến đổi do sự phát triển tiếng nói ở người là:
A. xương trán
B. xương mũi
C. xương hàm trên
D. xương hàm dưới
Câu 7: Hệ đảm nhận chức năng tiêu hóa và vận chuyển thức ăn, cũng như hấp thu các chất dinh dưỡng là
A. hệ tuần hoàn.
B. hệ hô hấp.
C. hệ tiêu hóa.
D. hệ bài tiết.
Câu 8: Trường hợp nào sau đây xảy ra hiện tượng hóa học?
A. Cắt trang giấy thành nhiều mảnh có hình vuông.
B. Cồn để trong lọ không đậy nắp bị cạn dần.
C. Đun nước, nước sôi bốc hơi.
D. Đốt cháy than để nấu nướng.
Câu 9: Xương nào dưới đây có hình dạng và cấu tạo có nhiều sai khác với các xương còn lại ?
A. Xương đốt sống
B. Xương bả vai
C. Xương cánh chậu
D. Xương sọ
Câu 10: Khi nói về áp suất, phát biểu nào sau đây đúng?
A. Áp suất là độ lớn của áp lực trên mặt bị ép.
B. Áp suất tỉ lệ nghịch với độ lớn của áp lực.
C. Với áp lực không đổi áp suất tỉ lệ nghịch với diện tích bị ép.
D. Áp suất không phụ thuộc diện tích bị ép.
Câu 11: Số nguyên tử H có trong 1,8 gam H2O là
A. 0,2989.1023.
B. 0,3011.1023.
C. 1,2044.1023.
D. 10,8396.1023.
Câu 12: Một bình hình trụ cao 2,5 m đựng đầy nước. Biết khối lượng riêng của nước là 1 000 kg/m3. Xác định áp suất của nước tác dụng lên đáy bình.
A. 2 500 Pa.
B. 400 Pa.
C. 250 Pa.
D. 25 000 Pa.
PHẦN II. TRẮC NGHIỆM ĐÚNG SAI (2 điểm)
Câu 13: Trong thí nghiệm, Nam trộn bột sắt (Fe) và bột lưu huỳnh (S), sau đó đun nóng hỗn hợp và nhận thấy có chất rắn màu đen được tạo thành là sắt (II) sulfide. Theo lý thuyết, các phát biểu dưới đây đúng hay sai?
a) Sản phẩm của phản ứng là sắt(II) sulfide.
b) Khi hỗn hợp bột sắt và lưu huỳnh tỏa nhiệt, đây là phản ứng hóa học tỏa nhiệt.
c) Nếu không đun nóng, hỗn hợp sắt và lưu huỳnh vẫn tự phản ứng và tỏa nhiệt.
d) Năng lượng nhiệt tỏa ra trong phản ứng là do các chất ban đầu hấp thụ nhiệt từ môi trường.
Câu 14: Một tàu ngầm di chuyển từ độ sâu 50 m xuống 200 m. Theo lý thuyết, các phát biểu dưới đây đúng hay sai?
a) Nếu trọng lượng riêng của nước biển là 10.300 N/m³, áp suất tăng thêm khi tàu ngầm lặn từ 50 m xuống 200 m là 1.545.000 N/m².
b) Khi tàu ngầm lặn xuống sâu hơn, áp suất tác dụng lên vỏ tàu tăng lên.
c) Nếu tàu ngầm nổi lên mặt nước, áp suất bên ngoài sẽ giảm nhưng áp suất bên trong vẫn giữ nguyên.
d) Nếu vỏ tàu không đủ cứng, áp suất lớn có thể làm bẹp tàu.
PHẦN III. TRẢ LỜI NGẮN (2 điểm)
Câu 15: Thể tích của 280 gam khí nitrogen ở điều kiện chuẩn là bao nhiêu lít?
Câu 16: Khối lượng riêng của nước đá vào khoảng 917 kg/m3. Vậy, 2 lít nước đá sẽ có trọng lượng khoảng bao nhiêu?
Câu 17: Hoà tan 4 gam NaOH vào nước để được 400 mL dung dịch. Nồng độ mol của dung dịch thu được là bao nhiêu mol/lít?
Câu 18: Cho các phát biểu sau:
(1) Phổi là một cơ quan của hệ tiêu hóa.
(2) Hệ tiêu hóa gồm ống tiêu hóa và tuyến tiêu hóa
(3) Tuyến giáp thuôc hệ nội tiết
(4) Dây thần kinh đóng vai trò rất quan trọng trong việc dẫn truyền xung thần kinh.
Có bao nhiêu phát biểu đúng?
PHẦN IV. TỰ LUẬN (3 điểm)
Câu 19: Trả lời các câu hỏi dưới đây
a) Khí methane (CH4) nặng hơn hay nhẹ hơn không khí bao nhiêu lần? Dưới đáy giếng thường xảy ra quá trình phân hủy chất hữu cơ, sinh ra khí methane. Hãy cho biết khí methane tích tụ dưới đáy giếng hay bị không khí đẩy bay lên trên?
b) Tính khối lượng của 7,437 lít khí O2 ở đkc.
Câu 20: Một diễn viên xiếc có khối lượng 65 kg cùng những chiếc ghế gỗ có khối lượng tổng cộng 60 kg, xếp chồng cân bằng trên một cái ghế 4 chân có khối lượng 5 kg. Diện tích tiếp xúc của một chân ghế là 10 cm2. Tính áp suất của mỗi chân ghế tác dụng lên sàn sân khấu.
Câu 21: Chúng ta cần làm gì để có hệ cơ phát triển cân đối và bộ xương chắc khỏe?
............
Nội dung đề thi vẫn còn trog file tải về
Đáp án có đầy đủ trong file tải về
................
Xem đầy đủ đề kiểm tra giữa kì 1 Khoa học tự nhiên 8 trong file tải về
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây: