Hỗ trợ tư vấn
Tư vấn - Giải đáp - Hỗ trợ đặt tài liệu
Mua gói Pro để tải file trên Download.vn (không bao gồm tài liệu cao cấp) và trải nghiệm website không quảng cáo
Tìm hiểu thêm »Bộ đề thi học kì 1 Hóa học 11 năm 2024 - 2025 gồm 11 đề có đáp án giải chi tiết kèm theo. Qua đề kiểm tra cuối kì 1 Hóa học 11 có đáp án giúp các bạn học sinh thuận tiện so sánh đối chiếu với bài làm của mình.
TOP 11 đề thi cuối kì 1 Hóa học 11 gồm 3 sách Cánh diều, Chân trời sáng tạo, Kết nối tri thức. Tài liệu được biên soạn theo cấu trúc rất đa dạng gồm 3 đề theo cấu trúc Form 2025 và 8 đề theo cấu trúc cũ trắc nghiệm kết hợp tự luận. Qua đó giúp giáo viên tham khảo lựa chọn ra đề thi cho các bạn học sinh của mình phù hợp với quy định chung của trường mình dạy học. Bên cạnh đó các bạn xem thêm: bộ đề thi học kì 1 Ngữ văn 11, đề thi học kì 1 Toán 11.



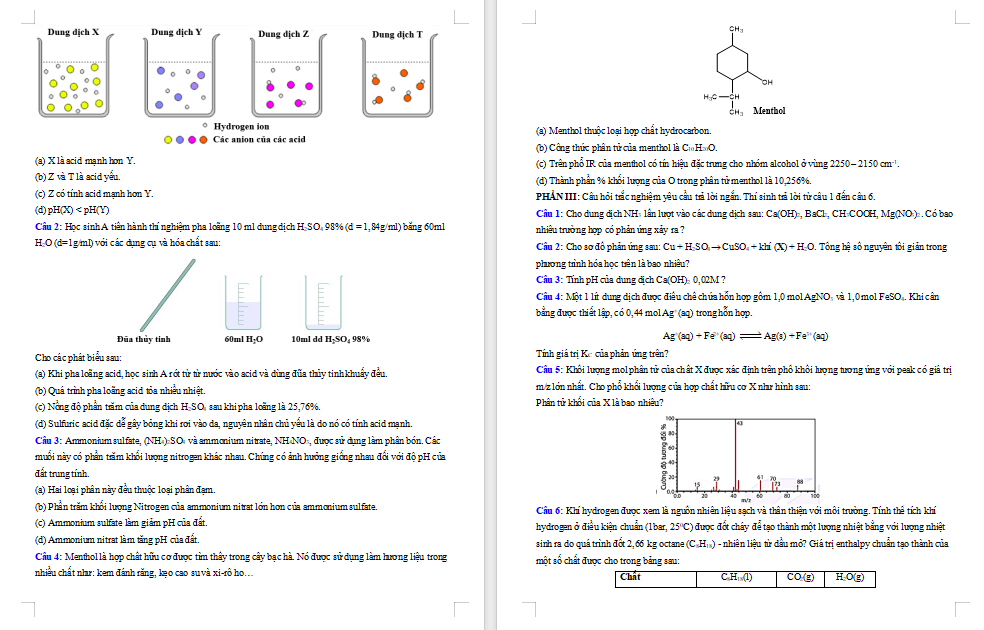
|
SỞ GDĐT ……… TRƯỜNG ……………………… |
ĐỀ KIỂM TRA CUỐI KÌ I NĂM 2024 - 2025 MÔN: HÓA HỌC LỚP 11 |
I. PHẦN TRẮC NGHIỆM (7,0 điểm)
Câu 1. Phản ứng nào sau đây là phản ứng thuận nghịch?
A. N2 + 3H2 ⇌ 2NH3.
B. Fe + 2HCl → FeCl2 + H2.
C. 2H2 + O2 ⟶ 2H2O.
D. 2KClO3 → 2KCl + 3O2.
Câu 2. Phát biểu nào sau đây về một phản ứng thuận nghịch tại trạng thái cân bằng là đúng?
A. Tốc độ của phản ứng thuận lớn hơn tốc độ của phản ứng nghịch.
B. Nồng độ của tất cả các chất trong hỗn hợp phản ứng là không đổi.
C. Nồng độ mol của chất phản ứng luôn bằng nồng độ mol của chất sản phẩm.
D. Phản ứng thuận và phản ứng nghịch đều dừng lại.
Câu 3. Trong các chất sau, chất không điện li là
A. KHCO3.
B. HCl.
C. KOH.
D. CH4.
Câu 4. Một dung dịch có nồng độ H+ bằng 0,01M thì pH và [OH−]của dung dịch này là
A. pH = 2; [OH-]=10-12 M.
B. pH = 2; [OH-]=10-10 M.
C. pH = 10-2; [OH-]=10-11 M.
D. pH = 2; [OH-]=10-11 M.
Câu 5. Trong không khí, chất nào sau đây chiếm phần trăm thể tích lớn nhất?
A. O2.
B. NO.
C. CO2.
D. N2.
Câu 6. Trong các phát biểu sau, phát biểu nào không đúng?
A. NH3 là chất khí không màu, không mùi, tan ít trong nước.
B. Khí NH3 nặng hơn không khí.
C. Khí NH3 dễ hoá lỏng, tan nhiều trong nước.
D. Phân tử NH3 chứa các liên kết cộng hoá trị phân cực.
Câu 7. Thành phần chính của quặng pyrite là
A. FeS.
B. FeS2.
C. CaSO4.
D. BaSO4.
Câu 8. Tính chất nào sau đây là tính chất Hóa học của sulfur?
A. Chất khí, không màu.
B. Chất rắn, màu nâu đỏ.
C. Không tan trong benzene.
D. Không tan trong nước.
Câu 9. Bước sơ cứu đầu tiên cần làm ngay khi một người sulfuric acid đậm đặc đổ vào tay gây bỏng là
A. rửa với nước lạnh nhiều lần.
B. trung hoà acid bằng NaHCO3.
C. băng bó tạm thời vết bỏng.
D. đưa đến cơ sở y tế gần nhất.
Câu 10. Chất nào sau đây được dùng để bổ sung khoáng chất cho phân bón, thức ăn gia súc …?
A. BaSO4.
B. CaSO4.
C. MgSO4.
D. NH4SO4.
Câu 11. Hoá học hữu cơ là ngành hoá học chuyên nghiên cứu về
A. hợp chất của carbon.
B. hydrocarbon.
C. dẫn xuất hydrocarbon.
D. hợp chất hữu cơ.
Câu 12. Trong thành phần phân tử hợp chất hữu cơ nhất định phải có nguyên tố nào sau đây?
A. Hydrogen.
B. Carbon.
C. Carbon, hydrogen và oxygen.
D. Oxygen.
Câu 13. Để tách dầu ăn ra khỏi hỗn hợp dầu ăn và nước nên sử dụng phương pháp tách chất nào sau đây?
A. Phương pháp chưng cất.
B. Phương pháp chiết.
C. Phương pháp kết tinh.
D. Sắc kí cột.
Câu 14. Phương pháp chưng cất thường được dùng để tách riêng từng chất trong hỗn hợp nào sau đây?
A. Nước và dầu ăn.
B. Bột mì và nước.
C. Cát và nước.
D. Nước và rượu.
Câu 15. Hydrocarbon là hợp chất hữu cơ có thành phần nguyên tố gồm
A. carbon và hydrogen.
B. hydrogen và oxygen.
C. carbon và oxygen.
D. carbon và nitrogen.
Câu 16. Cặp chất nào sau đây cùng dãy đồng đẳng?
A. CH4 và C2H4.
B. CH4 và C2H6.
C. C2H4 và C3H4.
D. C2H2 và C4H4.
Câu 17. Cho cân bằng hoá học sau:
![]() \(\mathrm{H}_2(g)+\mathrm{I}_2(g) \rightleftharpoons 2 \mathrm{HI}(g)\)
\(\mathrm{H}_2(g)+\mathrm{I}_2(g) \rightleftharpoons 2 \mathrm{HI}(g)\)
Biểu thức hằng số cân bằng của phản ứng trên là
![]() \(A. \mathrm{K}_{\mathrm{C}}=\frac{[2 H I]}{\left[H_2\right] \cdot\left[I_2\right]}.\)
\(A. \mathrm{K}_{\mathrm{C}}=\frac{[2 H I]}{\left[H_2\right] \cdot\left[I_2\right]}.\)
![]() \(B. \mathrm{K}_{\mathrm{C}}=\frac{\left[H_2\right] \cdot\left[I_2\right]}{2[H I]}.\)
\(B. \mathrm{K}_{\mathrm{C}}=\frac{\left[H_2\right] \cdot\left[I_2\right]}{2[H I]}.\)
![]() \(C. \mathrm{K}_{\mathrm{C}}=\frac{[H I]^2}{\left[H_2\right] \cdot\left[I_2\right]}.\)
\(C. \mathrm{K}_{\mathrm{C}}=\frac{[H I]^2}{\left[H_2\right] \cdot\left[I_2\right]}.\)
![]() \(D. \mathrm{K}_{\mathrm{C}}=\frac{\left[H_2\right] \cdot\left[I_2\right]}{[H I]^2}.\)
\(D. \mathrm{K}_{\mathrm{C}}=\frac{\left[H_2\right] \cdot\left[I_2\right]}{[H I]^2}.\)
Câu 18. Cho phản ứng thuận nghịch sau:![]() \(\mathrm{CO}_3^{2-}+\mathrm{H}_2 \mathrm{O} \rightleftharpoons \mathrm{HCO}_3^{-}+\mathrm{OH}^{-}\)
\(\mathrm{CO}_3^{2-}+\mathrm{H}_2 \mathrm{O} \rightleftharpoons \mathrm{HCO}_3^{-}+\mathrm{OH}^{-}\)
Trong phản ứng thuận, chất đóng vai trò là base theo thuyết Bronsted - Lowry là
![]() \(A. \mathrm{CO}_3^{2-}\).
\(A. \mathrm{CO}_3^{2-}\).![]() \(B. \mathrm{H}_2 \mathrm{O}.\)
\(B. \mathrm{H}_2 \mathrm{O}.\)![]() \(C. \mathrm{HCO}_3^{-}.\)
\(C. \mathrm{HCO}_3^{-}.\)
D. OH−.
Câu 19. Ammonia tan nhiều trong nước là do
A. phân tử có liên kết cộng hoá trị không cực.
B. có khả năng tạo liên kết hydrogen với nước.
C. phân tử có liên kết ion.
D. NH3 là một chất khí, mùi khai.
Câu 20. Trong khí quyển, khi có sấm sét nitrogen bị oxi hóa để tạo thành oxide của nitrogen. Oxide được tạo thành bởi quá trình này có công thức là
A. NO.
B. N2O5.
C. N2O.
D. N2O4.
Câu 21. Dãy gồm các kim loại không tác dụng với dung dịch HNO3 đặc, nguội là
A. Zn, Cu, Au, Pt.
B. Al, Fe, Au, Pt.
C. Mg, Cu, Au, Pt.
D. Mg, Ag, Au, Pt.
Câu 22. Cho phản ứng hoá học sau:
SO2 + 2H2S → 3S + 2H2O
Vai trò của của SO2 trong phản ứng trên là
A. chất khử.
B. acid.
C. base.
D. chất oxi hoá.
Câu 23. Cho kim loại Cu tác dụng với acid H2SO4 đặc, nóng. Khí sinh ra có tên gọi là
A. khí oxygen.
B. khí hydrogen.
C. khí carbonic.
D. khí sulfur dioxide.
Câu 24. Cho phổ hồng ngoại của chất X như hình dưới đây:
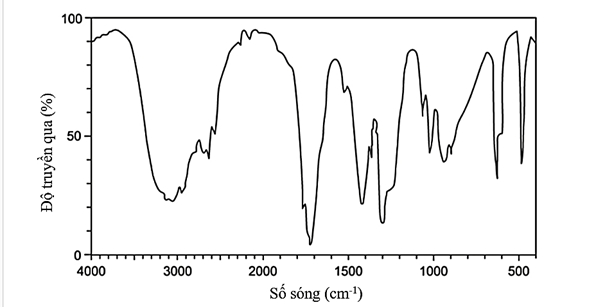
Phân tử chất X có chứa nhóm chức?
A. – CHO.
B. – COOH.
C. – OH.
D. –NH2.
Câu 25. Cho hình vẽ mô tả quá trình chiết hai chất lỏng không trộn lẫn vào nhau:
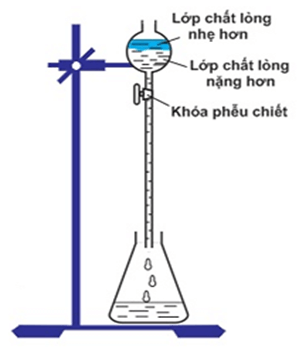
Phát biểu nào sau đây là sai?
A. Chất lỏng nhẹ hơn sẽ nổi lên trên trên phễu chiết.
B. Chất lỏng nhẹ hơn sẽ được chiết trước.
C. Chất lỏng nặng hơn sẽ ở phía dưới đáy phễu chiết.
D. Chất lỏng nặng hơn sẽ được chiết trước.
Câu 26. Phổ khối lượng của hợp chất hữu cơ X được cho như hình vẽ bên dưới:
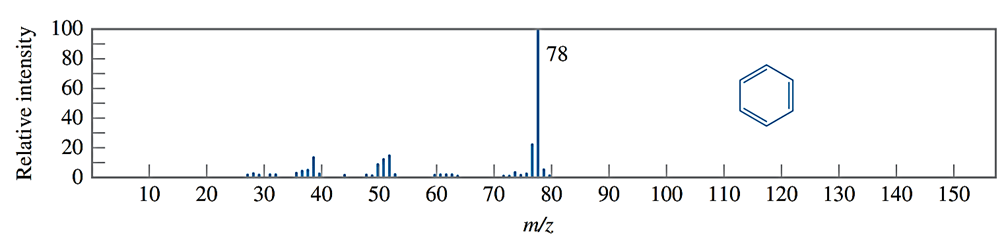
Phân tử khối của hợp chất hữu cơ X là
A. 80.
B. 78.
C. 76.
D. 50.
Câu 27. Công thức hoá học nào sau đây không phù hợp với thuyết cấu tạo hoá học?
A. CH3 – CH2 – OH.
B. CH3–O=CH–CH3.
C. CH3 – CH2 – CH2 – NH2.
D. CH3Cl.
Câu 28. Cặp chất nào sau đây là đồng phân của nhau?
A. CH3C6H4Cl và C6H5Cl.
B. CH3OH và CH3CH2OH.
C. CH3OCH3 và CH3 CH2OH.
D. C6H5OH và C2H5OH.
II. PHẦN TỰ LUẬN. (3,0 điểm)
Câu 29. Kết quả phân tích nguyên tố cho thấy thành phần phần trăm khối lượng các nguyên tố có trong hợp chất X như sau: carbon là 52,17%; hydrogen là 13,04%; còn lại là oxygen.
Biết phân tử khối của X là 46. Xác định công thức phân tử của hợp chất X.
Câu 30. Viết đồng phân cấu tạo mạch carbon hở của hợp chất hữu cơ có công thức phân tử: C4H10O.
Câu 31. Sulfur dioxide là chất khí, không màu, có mùi hắc, độc,… Đặc biệt, khí sulfur dioxide là một trong những tác nhân gây mưa acid. Hãy đề xuất các biện pháp nhằm giảm lượng khí sulfur dioxide thải vào bầu khí quyển?
Phần I: Trắc nghiệm
|
1 - A |
2 - B |
3 - D |
4 - A |
5 - D |
6 - B |
7 - B |
8 - D |
9 - A |
10 - C |
|
11 - D |
12 - B |
13 - B |
14 - D |
15 - A |
16 - B |
17 - C |
18 - A |
19 - B |
20 - A |
|
21 - B |
22 - D |
23 - D |
24 - B |
25 - B |
26 - B |
27 - B |
28 - C |
|
|
Phần II. Tự luận
Câu 29:
Gọi công thức tổng quát của X là CxHyOz.
%O = 100% - %C - %H = 34,79%.
![]() \(\text { Ta có tỉ lệ: } \mathrm{x}: \mathrm{y}: \mathrm{z}=\frac{\% C}{12}: \frac{\% H}{1}: \frac{\% O}{16}=\frac{52,17}{12}: \frac{13,04}{1}: \frac{34,79}{16}=2: 6: 1\)
\(\text { Ta có tỉ lệ: } \mathrm{x}: \mathrm{y}: \mathrm{z}=\frac{\% C}{12}: \frac{\% H}{1}: \frac{\% O}{16}=\frac{52,17}{12}: \frac{13,04}{1}: \frac{34,79}{16}=2: 6: 1\)
Vậy công thức đơn giản nhất của X là C2H6O.
Mối liên hệ giữa công thức phân tử và công thức đơn giản nhất của X là:
CxHyOz = (C2H6O)n.
Theo bài ra, phân tử khối của X là 46 nên: 46n = 46 Þ n = 1.
Công thức phân tử của X là: C2H6O.
Câu 30:
Các đồng phân:
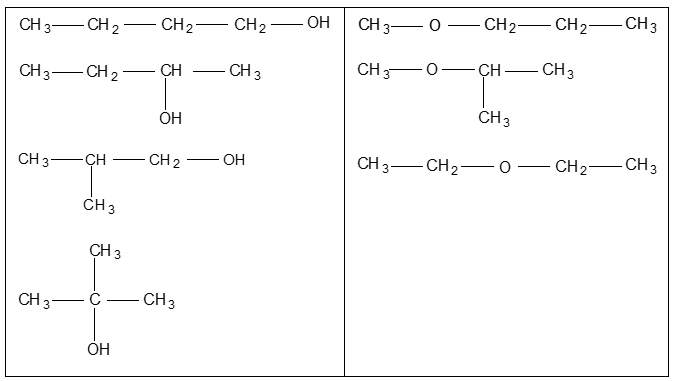
Câu 31:
Mội số biện pháp nhằm giảm lượng khí sulfur dioxide thải vào bầu khí quyển là:
- Tăng cường sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo;
- Sử dụng tiết kiệm, hiệu quả nguồn tài nguyên thiên nhiên;
- Cải tiến công nghệ sản xuất, có biện pháp xử lí khí thải và tái chế các sản phẩm phụ có chứa sulfur.
...............
Tải file tài liệu để xem thêm đề thi học kì 1 môn Hóa học 11
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây: