Hỗ trợ tư vấn
Tư vấn - Giải đáp - Hỗ trợ đặt tài liệu
Mua gói Pro để tải file trên Download.vn (không bao gồm tài liệu cao cấp) và trải nghiệm website không quảng cáo
Tìm hiểu thêm »TOP 83 Đề thi học kì 1 lớp 10 Kết nối tri thức năm 2024 - 2025 có đáp án kèm theo giúp thầy cô nhanh chóng xây dựng đề thi học kì 1 cho học sinh của mình.
Với 83 đề kiểm tra học kì 1 lớp 10 Kết nối tri thức gồm các môn: Ngữ văn, Toán, Tiếng Anh, Hóa học, Sinh học, Vật lí, Công nghệ, Tin học, Lịch sử, Địa lí, .. được biên soạn rất đa dạng với mức độ câu hỏi khác nhau. Hi vọng qua tài liệu này sẽ là người bạn đồng hành giúp các em học sinh lớp 10 dễ dàng ôn tập, hệ thống kiến thức, luyện giải đề, rồi so sánh kết quả thuận tiện hơn. Vậy sau đây là trọn bộ 83 đề thi học kì 1 lớp 10 Kết nối tri thức năm 2024 - 2025 mời các bạn cùng theo dõi và tải tại đây. Bên cạnh đó các bạn xem thêm ma trận đề thi học kì 1 lớp 10 sách Kết nối tri thức.


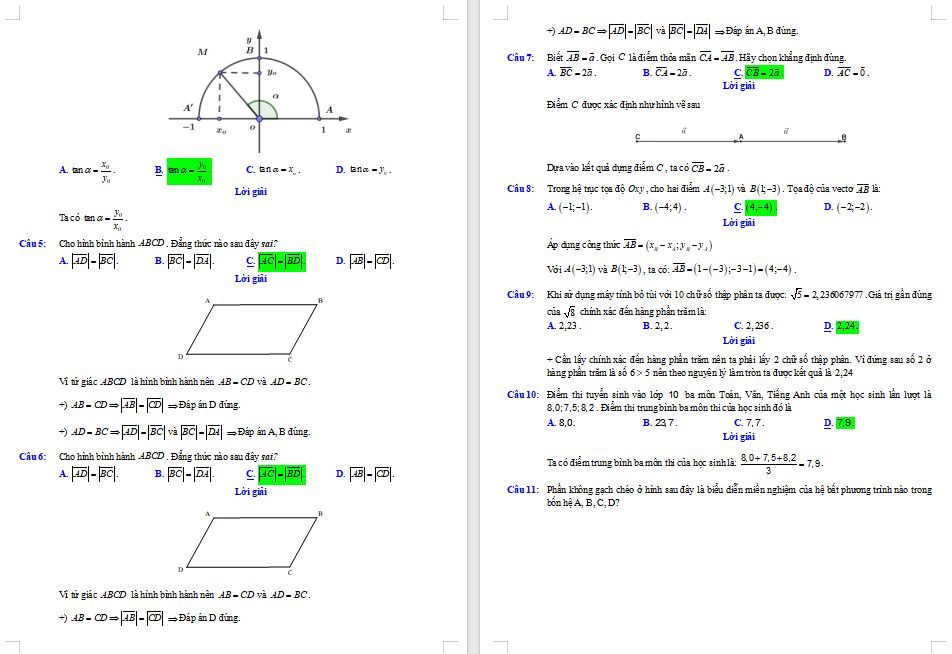
...........
Tải file tài liệu để xem thêm đề thi cuối kì 1 Toán 10
|
SỞ GD &ĐT ………. . |
KIỂM TRA HỌC KÌ 1 |
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1. Vỏ nguyên tử chứa
A. các electron mang điện tích dương, chuyển động rất nhanh xung quanh hạt nhân.
B. các electron không mang điện tích, chuyển động rất nhanh xung quanh hạt nhân.
C. các electron mang điện tích âm, chuyển động rất nhanh xung quanh hạt nhân.
D. các proton và neutron, chuyển động rất nhanh xung quanh hạt nhân.
Câu 2. Phát biểu sai khi nói về neutron?
A. tồn tại trong hạt nhân nguyên tử.
B. có khối lượng bằng khối lượng proton.
C. có khối lượng lớn hơn khối lượng electron.
D. không mang điện.
Câu 3. Trong bảng tuần hoàn, các nguyên tố hoá học trong bảng tuần hoàn được sắp xếp không theo nguyên tắc?
A. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp cùng một hàng.
B. Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp thành một cột.
C. Theo chiều tăng dần của điện tích hạt nhân nguyên tử.
D. Theo chiều tăng khối lượng nguyên tử.
Câu 4. Bảng tuần hoàn gồm có
A. 7 chu kì có 4 chu kì nhỏ và 3 chu kì lớn.
B. 8 chu kì có 4 chu kì nhỏ và 4 chu kì lớn.
C. 18 chu kì có 8 chu kì nhỏ và 10 chu kì lớn.
D. 7 chu kì có 3 chu kì nhỏ và 4 chu kì lớn.
Câu 5. Sulfur dạng kem bôi được sử dụng để điều chế kem trị mụn trứng cá. Nguyên tử sulfur có phân lớp electron ngoài cùng là 3p4. Phát biểu nào sau đây sai khi nói về nguyên tử sulfur?
A. Lớp ngoài cùng của sulfur có 6 electron.
B. Hạt nhân nguyên tử sulfur có 16 electron.
C. Trong bảng tuần hoàn sulfur nằm ở chu kì 3.
D. Sulfur nằm ở nhóm VIA.
Câu 6. Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân nguyên tử
A. bán kính nguyên tử và độ âm điện đều giảm.
B. bán kính nguyên tử và độ âm điện đều tăng.
C. bán kính nguyên tử giảm và độ âm điện tăng.
D. bán kính nguyên tử tăng và độ âm điện giảm.
Câu 7. Cho cấu hình của nguyên tố X là 1s²2s²2p63s². Phát biểu đúng là
A. X ở ô 12, chu kỳ 3, nhóm IIIA trong bảng tuần hoàn.
B. X ở ô 12, chu kỳ 3, nhóm IIIB trong bảng tuần hoàn.
C. X ở ô 12, chu kỳ 2, nhóm IIA trong bảng tuần hoàn.
D. X ở ô 12, chu kỳ 3, nhóm IIA trong bảng tuần hoàn.
Câu 8. Những đại lượng và tính chất nào của nguyên tố hóa học cho dưới đây không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử?
A. Tính kim loại và tính phi kim.
B. Khối lượng nguyên tử.
C. Tính acid - base của các hydroxygende.
D. Cấu hình electron lớp ngoài cùng.
Câu 9. Nguyên tử của nguyên tố nào sau đây có độ âm điện lớn nhất? Cho biết nguyên tố này được sử dụng trong công nghệ hàn, sản xuất thép và methanol.
A. B.
B. N.
C. O.
D. Mg.
Câu 10. Nguyên tử của nguyên tố nào sau đây có tính kim loại mạnh nhất? Cho biết nguyên tố này sử dụng trong đồng hồ nguyên tử, với độ chính xác ở mức giây trong hàng nghìn năm.
A. Hydrogen.
B. Berylium.
C. Casesium.
D. Phosphorus.
Câu 11. Xét ba nguyên tố có cấu hình electron lần lượt: X:1s22s22p63s1, Q:1s22s22p63s2, Z: 1s22s22p63s23p1. Tính base tăng dần của các hydroxide là
A. XOH < Q(OH)2< Z(OH)3.
B. Z(OH)3 < XOH < Q(OH)2.
C. Z(OH)3< Q(OH)2 < XOH.
D. XOH < Z(OH)3 < Q(OH)2.
Câu 12. Nguyên tử của nguyên tố X có bán kính nguyên tử rất lớn. Phát biểu nào sau đây về X là đúng?
A, Độ âm điện của X rất lớn và X là phi kim.
B. Độ âm điện của X rất nhỏ và X là phi kim.
C. Độ âm điện của X rất lớn và X là kim loại.
D. Độ âm điện của X rất nhỏ và X là kim loại.
Câu 13. Liên kết hóa học là
A. sự kết hợp của các hạt cơ bản hình thành nguyên tử bền vững.
B. sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
C. sự kết hợp của các phân tử hình thành các chất bền vững.
D. sự kết hợp của chất tạo thành vật thể bền vững.
Câu 14. Trong phân tử iodine (I2), mỗi nguyên tử iodine đã góp một electron để tạo cặp electron chung. Mỗi nguyên tử iodine đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây?
A. Xe.
B. Ne.
C. Ar.
D. Kr.
Câu 15. Tính chất nào sau đây là tính chất của hợp chất ion?
A. Hợp chất ion có nhiệt độ nóng chảy thấp.
B. Hợp chất ion có nhiệt độ nóng chảy cao.
C. Hợp chất ion dễ hoá lỏng.
D. Hợp chất ion có nhiệt độ sôi không xác định.
Câu 16. Điều nào sau đây không đúng khi nói về hợp chất sodium oxide (Na2O)?
A. Trong phân tử Na2O, các ion sodium Na+và ion oxide O2- đều đạt cấu hình electron bền vững của khí hiếm neon.
B. Phân tử Na2O tạo bỡi lực hút tĩnh điện giữa hai ion Na+và một ion O2-. .
C. Là chất rắn trong điều kiện thường.
D. Không tan trong nước chỉ tan trong dung môi không phân cực như benzene, cacbon tetrachloride.
Câu 17. Liên kết hóa học trong phân tử Br2 thuộc loại liên kết
A. cộng hoá trị không cực.
B. hydrogen.
C. cộng hoá trị có cực.
D. ion
Câu 18. Liên kết hoá học giữa các nguyên tử trong phân tử H2O là liên kết
A. cộng hoá trị không phân cực.
B. hydrogen.
C, cộng hoá trị phân cực.
D. ion
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Câu 1. Theo mô hình nguyên tử hiện đại
a. Các electron chuyển động không theo những quỹ đạo xác định trong cả khu vực không gian xung quanh hạt nhân.
b. Mỗi AO nguyên tử chỉ có thể chứa được 1 electron.
c. Các electron trên các phân lớp 1s, 2s, 3s có năng lượng bằng nhau.
d. Số lượng các orbital trong một phân lớp (s, p, d) luôn là một số lẻ.
Câu 2. Cho các nguyên tố Na (Z = 11), Cl (Z = 17), F (Z = 9) và K (Z = 19).
a. Độ âm điện của các nguyên tố tăng dần theo thứ tự: K < Cl < Na < F.
b. Nguyên tố có tính phi kim mạnh nhất trong dãy là Fluorine (F).
c. Nguyên tố có tính kim loại mạnh nhất trong dãy là Sodium (Na).
d. Nguyên tố Na và F ở cùng một chu kì.
. . . . . . . . . . .
Phần I: Mỗi câu trả lời đúng được 0,25 điểm
| Câu | Đáp án | Câu | Đáp án |
| 1 | C | 10 | C |
| 2 | B | 11 | C |
| 3 | D | 12 | D |
| 4 | D | 13 | B |
| 5 | B | 14 | A |
| 6 | C | 15 | B |
| 7 | D | 16 | D |
| 8 | B | 17 | A |
| 9 | C | 18 | C |
Phần II: Điểm tối đa của 01 câu hỏi là 1 điểm
- Thí sinh chỉ lựa chọn chính xác 01 ý trong 1 câu hỏi được 0,1 điểm
- Thí sinh chỉ lựa chọn chính xác 02 ý trong 1 câu hỏi được 0,25 điểm
- Thí sinh chỉ lựa chọn chính xác 03 ý trong 1 câu hỏi được 0,5 điểm
- Thí sinh lựa chọn chính xác cả 04 ý trong 1 câu hỏi được 1 điểm
|
Câu |
Lệnh hỏi |
Đáp án (Đ/S) |
Câu |
Lệnh hỏi |
Đáp án (Đ/S) |
|
1 |
a |
Đ |
3 |
a |
S |
|
b |
S |
b |
Đ |
||
|
c |
S |
c |
Đ |
||
|
d |
Đ |
d |
Đ |
||
|
2 |
a |
S |
4 |
a |
Đ |
|
b |
Đ |
b |
Đ |
||
|
c |
Đ |
c |
S |
||
|
d |
Đ |
d |
Đ |
Phần III: Mỗi câu trả lời đúng được 0,25 điểm
|
Câu |
Đáp án |
Câu |
Đáp án |
|
1 |
6 |
4 |
3 |
|
2 |
20,19 |
5 |
9 |
|
3 |
3 |
6 |
2 |
Lưu ý: Phần nhận biết HS trả lời đáp án khác nhưng đúng vẫn cho điểm tối đa
.............
Mời các bạn tham khảo chi tiết đề thi theo các link tải bên trên
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây: