Hỗ trợ tư vấn
Tư vấn - Giải đáp - Hỗ trợ đặt tài liệu
Tài liệu cao cấp không áp dụng tải nhanh miễn phí cho thành viên gói Pro.
Tìm hiểu thêm »Đề thi cuối học kì 1 Hóa học 10 năm 2025 - 2026 mang đến 18 đề kiểm tra có đầy đủ đáp án ma trận và bản đặc tả đề thi. Qua đó giúp các bạn học sinh có thêm nhiều tài liệu học tập hữu ích, luyện giải đề trước khi bước vào kì thi chính thức.
TOP 18 Đề kiểm tra cuối kì 1 Hóa học 10 năm 2025 được biên soạn theo Công văn 7991 và cấu trúc đề minh họa của Bộ GD&ĐT dưới dạng file Word dễ dàng chỉnh sửa. Qua đề kiểm tra học kì 1 Hóa học 10 sẽ giúp các em học sinh nắm vững kiến thức, kỹ năng đã học trong học kì 1, làm quen với áp lực thời gian, cách phân bổ thời gian hợp lý, trình bày bài thi rõ ràng, mạch lạc. Bên cạnh đó các bạn xem thêm: bộ đề thi học kì 1 môn Ngữ văn 10, bộ đề thi học kì 1 môn Lịch sử lớp 10.
Bộ đề thi cuối kì 1 Hóa học 10 năm 2025 - 2026 có cấu trúc như sau. Tùy theo yêu cầu của từng Sở mà thầy cô ra đề cho các em nhé.
File Word dễ dàng chỉnh sửa
1. Bộ đề thi cuối kì 1 Hóa học 10 Kết nối tri thức gồm:
- 2 Đề biên soạn hoàn theo Công văn 7991
- 5 Đề biên soạn theo cấu trúc đề minh họa: có đầy đủ đáp án.
2. Bộ đề thi cuối kì 1 Hóa học 10 Cánh diều gồm:
3. Bộ đề thi cuối kì 1 Hóa học 10 Chân trời sáng tạo gồm:
- 2 Đề biên soạn hoàn theo Công văn 7991
- 3 Đề biên soạn theo cấu trúc đề minh họa: có đầy đủ đáp án. (Chưa có ma trận)
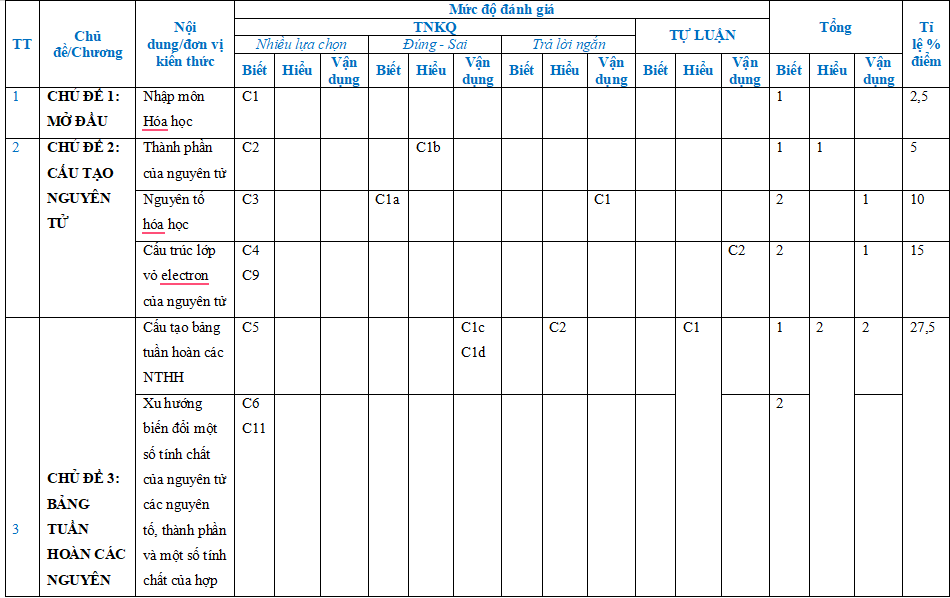

Ma trận và bản đặc tả có đầy đủ trong file tải

Nội dung đề thi vẫn còn trong file tải
Đáp án có đầy đủ trong file tải
...............
Tải file về để xem trọn bộ đề thi học kì môn Hóa học 10
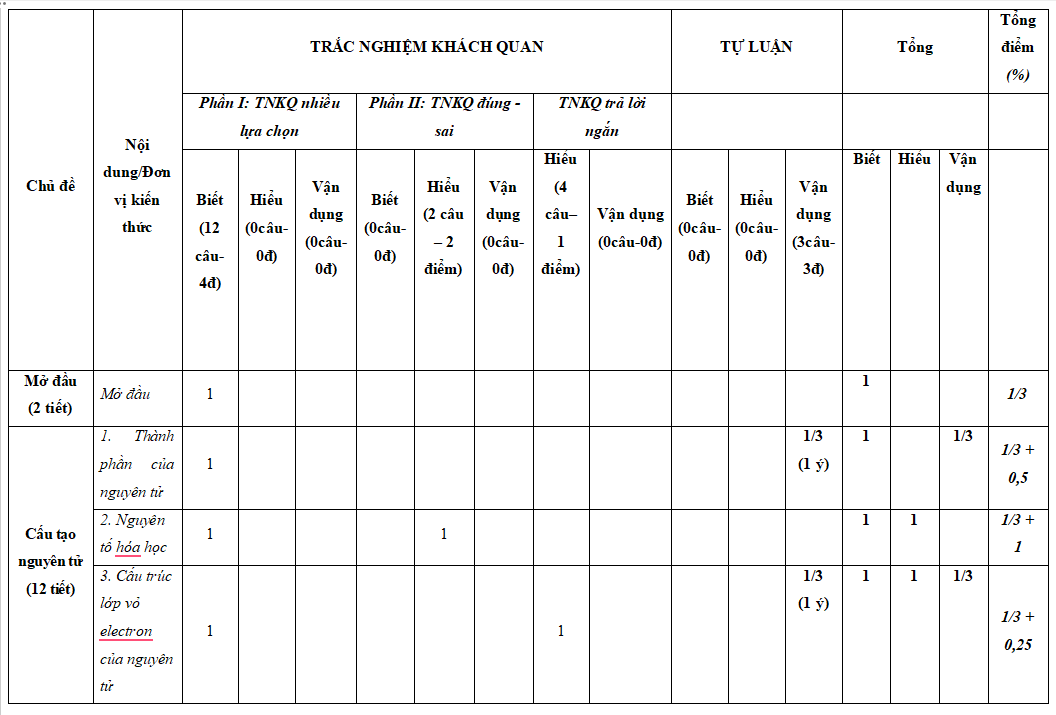
...................
Xem đầy đủ nội dung ma trận, bản đặc tả trong file tải về

.................
Nội dung có đầy đủ trong file tải về
Đáp án có đầy đủ trong file tải về


Đáp án có đầy đủ trong file tải
Tải file tài liệu để xem thêm đề thi học kì 1 môn Hóa học 10
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:










Bộ đề thi học kì 1 môn Hóa học lớp 10 năm 2025 - 2026 (Sách mới)
Bộ đề thi học kì 1 môn Hóa học lớp 10 năm 2025 - 2026 (Sách mới)
149.000đ
Vui lòng nhập số điện thoại hoặc email.

KH khi chuyển khoản
và giữ nguyên cửa sổ này để tải tài liệu tự động.