Hỗ trợ tư vấn
Tư vấn - Giải đáp - Hỗ trợ đặt tài liệu
Tài liệu cao cấp không áp dụng tải nhanh miễn phí cho thành viên gói Pro.
Tìm hiểu thêm »Đề thi cuối học kì 1 Hóa học 10 Kết nối tri thức năm 2025 - 2026 mang đến 7 đề kiểm tra có đầy đủ đáp án ma trận và bản đặc tả đề thi. Qua đó giúp các bạn học sinh có thêm nhiều tài liệu học tập hữu ích, luyện giải đề trước khi bước vào kì thi chính thức.
TOP 7 Đề kiểm tra cuối kì 1 Hóa học 10 Kết nối tri thức năm 2025 được biên soạn theo Công văn 7991 và cấu trúc đề minh họa của Bộ GD&ĐT dưới dạng file Word dễ dàng chỉnh sửa. Qua đề kiểm tra học kì 1 Hóa học 10 Kết nối tri thức sẽ giúp các em học sinh nắm vững kiến thức, kỹ năng đã học trong học kì 1, làm quen với áp lực thời gian, cách phân bổ thời gian hợp lý, trình bày bài thi rõ ràng, mạch lạc. Ngoài ra các bạn xem thêm: bộ đề thi học kì 1 môn Vật lí 10, bộ đề thi học kì 1 Lịch sử 10 Kết nối tri thức.
Lưu ý: Bộ đề thi cuối kì 1 Hóa học 10 Kết nối tri thức có cấu trúc như sau. Tùy theo yêu cầu của từng Sở mà thầy cô ra đề cho các em nhé.
File Word dễ dàng chỉnh sửa
- 2 Đề biên soạn hoàn theo Công văn 7991
- 5 Đề biên soạn theo cấu trúc đề minh họa: có đầy đủ đáp án.
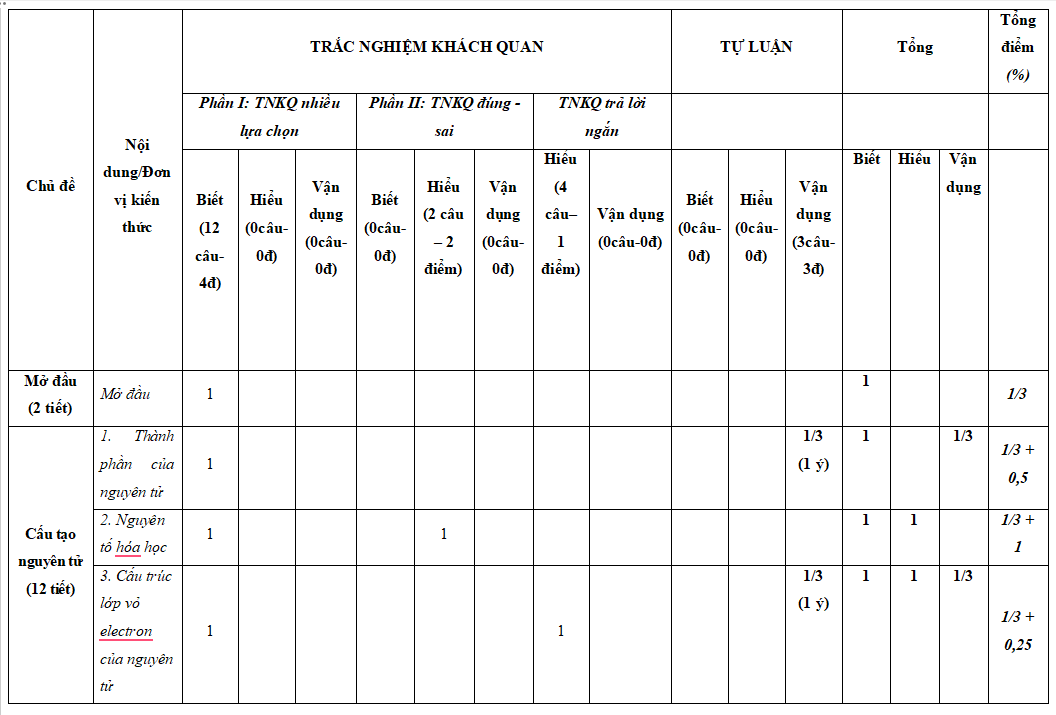
...................
Xem đầy đủ nội dung ma trận, bản đặc tả trong file tải về

.................
Nội dung có đầy đủ trong file tải về
Đáp án có đầy đủ trong file tải về
...................
Mời các bạn tải file về để xem trọn bộ đề thi cuối kì 1 Hóa học 10 Kết nối tri thức
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:









Bộ đề thi học kì 1 môn Hóa học 10 năm 2025 - 2026 sách Kết nối tri thức với cuộc sống
Bộ đề thi học kì 1 môn Hóa học 10 năm 2025 - 2026 sách Kết nối tri thức với cuộc sống
99.000đ
Vui lòng nhập số điện thoại hoặc email.

KH khi chuyển khoản
và giữ nguyên cửa sổ này để tải tài liệu tự động.