Hỗ trợ tư vấn
Tư vấn - Giải đáp - Hỗ trợ đặt tài liệu
Mua gói Pro để tải file trên Download.vn (không bao gồm tài liệu cao cấp) và trải nghiệm website không quảng cáo
Tìm hiểu thêm »Đề thi giữa kì 1 Hóa học 10 Chân trời sáng tạo năm 2025 - 2026 mang đến đề kiểm tra có đáp án giải chi tiết kèm theo bảng ma trận, đặc tả đề thi. Qua đề kiểm tra giữa kì 1 Hóa học 10 giúp các bạn học sinh ôn luyện củng cố kiến thức để biết cách ôn tập đạt kết quả cao.
Đề kiểm tra giữa kì 1 Hóa học 10 Chân trời sáng tạo năm 2025 được biên soạn dưới dạng file Word với cấu trúc mới theo Công văn 7991 gồm 3-2-2-3 theo tỉ lệ câu hỏi trắc nghiệm lựa chọn đáp án đúng, đúng sai, trả lời ngắn và tự luận. Hi vọng qua đề kiểm tra giữa kì 1 Hóa học 10 Chân trời sáng tạo sẽ giúp các em học sinh nắm vững kiến thức, kỹ năng toán học đã học trong nửa đầu học kì, làm quen với áp lực thời gian, cách phân bổ thời gian hợp lý, trình bày bài thi rõ ràng, mạch lạc.Ngoài ra các bạn xem thêm bộ đề thi giữa kì 1 Ngữ văn 10 Chân trời sáng tạo.
PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1. Đối tượng nghiên cứu của hóa học là
A. sự phát triển của thực vật và thực vật.
B. khí quyển và sự biến đổi khí hậu.
C. sự phát triển của loài người.
D. chất và sự biến đổi của chất.
Câu 2. Các hạt cấu tạo nên hầu hết các nguyên tử là
A. Electron, proton và neutron.
B. Electron và neutron
C. Proton và neutron .
D. Electron và proton.
Câu 3. Trong nguyên tử, loại hạt có khối lượng không đáng kể so với các hạt còn lại là
A. Proton.
B. Neutron.
C. Electron.
D. Neutron và electron.
Câu 4. Đồng vị là những nguyên tử của cùng một nguyên tố, có số proton bằng nhau nhưng khác nhau
A. số hiệu nguyên tử.
B. số neutron.
C. hóa trị.
D. số electron.
Câu 5. Phổ khối, hay phổ khối lượng (MS: Mass Spectrum) chủ yếu được sử dụng đề xác định phân tử khối, nguyên từ khối của các chất và hàm lượng các đồng vị bền của một nguyên tố. Phổ khối của neon được biểu diễn như ở hình bên.
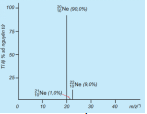
Trục tung biểu thị hàm lượng phần trăm về số nguyên tử của từng đòng vị, trục hoành biểu thị tỉ số cùa nguyên tử khối (m) của mỗi đồng vị với điện tích của các ion đồng vị tương ứng (điện tích z của các ion đồng vị neon đều bằng +1). Nguyên tử khối trung bình của Neon.
A. 20,19.
B. 19,98.
C. 18,21.
D. 22.
Câu 6. Orbital nguyên tử là
A. Đám mây chứa electron có dạng hình cầu.
B. Đám mây chứa electron có dạng hình số tám nổi.
C. Khu vực không gian xung quanh hạt nhân nguyên tử mà tại đó xác suất tìm thấy electron trong khu vực đó là lớn nhất.
D. quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước năng lượng xác định.
..........
PHẦN II. Câu trắc nghiệm đúng - sai. Thí sinh trả lời từ câu 1 đến câu 2. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1. Nguyên tử của nguyên tố X có kí hiệu như sau: .
A. Lớp vỏ nguyên tử của nguyên tố X có 13 electron.
B. Điện tích hạt nhân nguyên tử X là +14.
C. Cấu hình electron của X là 1s22s22p63s23p2.
D. X có khả năng nhường 3 electron để tạo thành ion X3+.
Câu 2. Copper (Cu) thường được sử dụng làm dây dẫn điện.Từ phổ khối lượng các đồng vị của Cu (Z=29) trong tự nhiên ở hình dưới đây:
A.Copper(Cu) có hai đồng vị
B. Cả hai đồng vị trên đều có cùng số khối.
C. Kí hiệu nguyên tử của hai đồng vị lần lượt là và .
D. Giá trị nguyên tử khối trung bình của Cu là 63,6.
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 4.
Câu 1. Khối, hay phổ khối lượng (MS: Mass Spectrum) chủ yếu được sử dụng đề xác định phân tử khối, nguyên tử khối của các chất và hàm lượng các đồng vị bền của một nguy ê n tố . Phổ khối của neon đư ợc biểu diễn nh ư ở hình bên dưới:
...........
Xem đầy đủ đề thi trong file tải về
Đáp án có trong file tải về
...................
Tải file tài liệu để xem thêm Đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây: