Hỗ trợ tư vấn
Tư vấn - Giải đáp - Hỗ trợ đặt tài liệu
Mua gói Pro để tải file trên Download.vn (không bao gồm tài liệu cao cấp) và trải nghiệm website không quảng cáo
Tìm hiểu thêm »Đề thi cuối kì 2 Hóa học 10 Cánh diều năm 2023 - 2024 bao gồm 4 đề kiểm tra học kì 2 có đáp án giải chi tiết kèm theo bảng ma trận.
TOP 4 Đề kiểm tra cuối kì 2 Hóa học 10 Cánh diều được xây dựng với cấu trúc đề rất đa dạng, bám sát nội dung chương trình học trong sách giáo khoa lớp 10. Thông qua 4 đề kiểm tra cuối kì 2 Hóa học 10 sẽ giúp các em rèn luyện những kĩ năng cần thiết và bổ sung những kiến thức chưa nắm vững để chuẩn bị kiến thức thật tốt. Với 4 đề kiểm tra cuối kì 2 Hóa học 10 Cánh diều có đáp án kèm theo sẽ giúp các bạn so sánh được kết quả sau khi hoàn thành bài tập.
|
SỞ GD&ĐT ……..
TRƯỜNG THPT…………….. (Đề thi gồm có 03 trang)
|
ĐỀ KIỂM TRA HỌC KỲ II NĂM HỌC 2023-2024 Môn: Hóa học 10 Thời gian làm bài: 60 phút, không kể thời gian giao đề |
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Số oxi hoá của carbon trong hợp chất CO là
A. +1.
B. -1.
C. +2.
D. -2.
Câu 2: Cho các chất và ion sau: NH3; NO; Ca(NO3)2; NH4+; (NH4)2SO4; N2O3. Số trường hợp trong đó nitrogen có số oxi hoá -3 là
A. 4.
B. 3.
C. 2.
D. 1.
Câu 3: Cho các phát biểu sau:
(a). Sự oxi hoá là sự nhường electron hay sự làm tăng số oxi hoá.
(b). Trong quá trình oxi hoá, chất khử nhận electron.
(c). Sự khử là sự nhận electron hay là sự làm giảm số oxi hoá.
(d). Trong quá trình khử, chất oxi hoá nhường electron.
Số phát biểu đúng là
A. 4.
B. 1.
C. 2.
D. 3.
Câu 4: Cho phản ứng sau: 2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O. Vai trò của H2SO4 trong phản ứng là
A. chất khử.
B. chất oxi hoá.
C. chất tạo môi trường.
D. vừa là chất oxi hoá, vừa là chất tạo môi trường phản ứng.
Câu 5: Cho các phản ứng hoá học sau:
(1) Phản ứng đốt cháy hydrogen: 2H2(g) + O2(g) → 2H2O(l).
(2) Phản ứng nung vôi: CaCO3(s) → CaO(s) + CO2(g).
Nhận xét nào sau đây là đúng?
A. Phản ứng (1) thu nhiệt, phản ứng (2) toả nhiệt.
B. Cả hai phản ứng đều toả nhiệt
C. Phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
D. Cả hai phản ứng đều thu nhiệt.
Câu 6. S vừa là chất khử, vừa là chất oxi hóa trong phản ứng nào sau đây?
A. S + O2 → SO2
B. S + 6HNO3 → H2SO4 + 6NO2 + 2H2O
C. S + Mg → MgS
D. S + 6NaOH → 2Na2S + Na2SO3 + 3H2O
Câu 7: Cho các phát biểu sau:
(a). Biến thiên enthalpy chuẩn của một phản ứng hoá học là lượng nhiệt kèm theo phản ứng đó ở áp suất 1 atm và 25 oC.
(b). Nhiệt (toả ra hay thu vào) kèm theo một phản ứng được thực hiện ở 1 bar và 298 K là biến thiên enthalpy chuẩn của phản ứng đó.
(c). Một số phản ứng khi xảy ra làm môi trường xung quanh nóng lên là phản ứng thu nhiệt.
(d). Một số phản ứng khi xảy ra làm môi trường xung quanh lạnh đi là do các phản ứng này thu nhiệt và lấy nhiệt từ môi trường.
Số phát biểu đúng là
A. 4.
B. 1.
C. 3.
D. 2.
Câu 8: Cho phản ứng sau:
2H2(g) + O2(g) → 2H2O(g) Δ r H 0 298 = − 483 , 64 kJ ∆rH2980=-483,64kJ
Enthalpy tạo thành chuẩn của H2O(g) là
A. – 241,82 kJ/ mol.
B. 241,82 kJ/ mol.
C. – 483,64 kJ/ mol.
D. 483,64 kJ/ mol.
Câu 18. Cho cân bằng (trong bình kín) sau:
CO (k) + H2O (k) ⇆ CO2 (k) + H2 (k); ΔH < 0
Trong các yếu tố:
Dãy gồm các yếu tố đều làm thay đổi cân bằng của hệ là :
A. (1), (4), (5).
B. (1), (2), (3).
C. (2), (3), (4).
D. (1), (2), (4).
Câu 10: Cho phản ứng sau: H2(g) + Cl2(g) → 2HCl(g). Biến thiên enthalpy chuẩn của phản ứng là
Biết: Eb (H – H) = 436 kJ/mol, Eb (Cl – Cl) = 243 kJ/mol, Eb (H – Cl) = 432 kJ/ mol.
A. +158 kJ.
B. -158 kJ.
C.+185 kJ.
D. -185 kJ.
Câu 11: Khi cho một lượng xác định chất phản ứng vào bình để cho phản ứng hoá học xảy ra, tốc độ phản ứng sẽ
A. không đổi cho đến khi kết thúc.
B. tăng dần cho đến khi kết thúc.
C. chậm dần cho đến khi kết thúc.
D. tuân theo định luật tác dụng khối lượng.
Câu 12 Cho 100ml dung dịch KOH 1M tác dụng với 100 ml dung dịch HCl aM, sau phản ứng thu được dung dịch Y có chứa 6,9875 gam chất tan. Vậy giá trị a là
A. 0,75M
B. 0,5M
C. 1,0M
D. 0,25M
Câu 13. Hòa tan 2 gam một kim loại M thuộc nhóm IIA trong dung dịch HCl (dư). Cô cạn dung dịch, thu được 5,55 gam muối. Kim loại X là
A. Ca
B. Ba
C. Mg
D. Be
Câu 14. Thuốc thử nào sau đây dùng để phân biệt khí H2S với khí CO2?
A. dung dịch HCl
B. dung dịch Pb(NO3)2
C. dung dịch K2SO4
D. dung dịch NaCl
Câu 15. Cho 1,03 gam muối natri halogenua (X) tác dụng với dung dịch AgNO3 dư thì thu được một kết tủa, kết tủa nà sau khi phân hủy hoàn toàn cho 1,08 gam bạc. Công thức của muối X là
A. NaF
B. NaBr
C. NaI
D. NaCl
Câu 16. Dãy chất nào trong các dãy sau đây gồm các chất đều thể hiện tính oxi hóa khi phản ứng với SO2?
A. H2S, O2, nước brom
B. O2, nước brom, dung dịch KMnO4
C. Dung dịch NaOH, O2, dung dịch KMnO4
D. Dung dịch BaCl2, CaO, nước brom
Câu 17: Hiện tượng nào dưới đây thể hiện ảnh hưởng của nhiệt độ đến tốc độ phản ứng?
A. Thanh củi được chẻ nhỏ hơn thì sẽ cháy nhanh hơn.
B. Quạt gió vào bếp than để thanh cháy nhanh hơn.
C. Thức ăn lâu bị ôi thiu hơn khi để trong tủ lạnh.
D. Các enzyme làm thúc đẩy các phản ứng sinh hóa trong cơ thể.
Câu 18: Thí nghiệm nghiên cứu tốc độ phản ứng giữa kẽm (zinc) với dung dịch hydrochloric acid của hai nhóm học sinh được mô tả bằng hình sau:
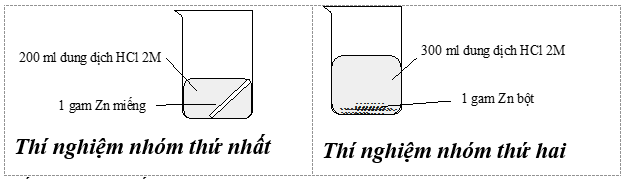
Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do
A. nhóm thứ hai dùng axit nhiều hơn.
B. diện tích bề mặt kẽm bột lớn hơn kẽm miếng.
C. nồng độ kẽm bột lớn hơn.
D. áp suất tiến hành thí nghiệm nhóm thứ hai cao hơn nhóm thứ nhất.
Câu 19: Cho các phát biểu sau về nguyên tử các nguyên tố nhóm VIIA:
(a). Có 7 electron hóa trị.
(b). Theo chiều tăng dần của điện tích hạt nhân nguyên tử thì độ âm điện giảm.
(c). Theo chiều tăng dần điện tích hạt nhân nguyên tử thì khả năng hút cặp electron liên kết giảm.
(d). Theo chiều tăng dần điện tích hạt nhân nguyên tử thì bán kính nguyên tử giảm.
Số phát biểu đúng là
A. 4.
B. 3.
C. 2.
D. 1.
Câu 20: Khi phản ứng với các chất khác, nguyên tử halogen có xu hướng nào sau đây?
A. Nhận thêm 1 electron từ nguyên tử khác.
B. Góp chung electron hóa trị với nguyên tử nguyên tố khác.
C. Nhường đi 7 electron ở lớp ngoài cùng.
D. Cả A và B đều đúng.
Câu 21: Đặc điểm chung của các nguyên tố nhóm halogen là
A. chất khí ở điều kiện thường.
B. có tính oxi hóa mạnh.
C. vừa có tính oxi hóa vừa có tính khử
D. phản ứng mãnh liệt với nước.
Câu 22: Cho phản ứng X2 + 2NaBr(aq) → 2NaX(aq) + Br2. X có thể là chất nào sau đây?
A. Cl2.
B. I2.
C..F2.
D. O2.
Câu 23. Dãy chất nào trong các dãy sau đây gồm các chất đều thể hiện tính oxi hóa khi phản ứng với SO2?
A. H2S, O2, nước brom
B. O2, nước brom, dung dịch KMnO4
C. Dung dịch NaOH, O2, dung dịch KMnO4
D. Dung dịch BaCl2, CaO, nước brom
Câu 24: Cho các phát biểu sau về ion halide X-:
(a). Dùng dung dịch silver nitrate sẽ phân biệt được các ion F-, Cl-, Br-, I-.
(b). Với sulfuric acid đặc, các ion Cl-, Br-, I- thể hiện tính khử, ion F- không thể hiện tính khử.
(c). Tính khử của các ion halide tăng theo dãy: Cl-, Br-, I-.
(d). Ion Cl- kết hợp ion Ag+ tạo AgCl là chất không tan, màu vàng.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 25: Dung dịch nước của chất nào sau đây được sử dụng để khắc các chi tiết lên thủy tinh?
A. HF.
B. HCl.
C. HBr.
D. HI.
Câu 26: Hòa tan 0,48 gam magnesium (Mg) trong dung dịch HCl dư. Sau phản ứng thu được thể tích khí H2 ở điều kiện chuẩn là
A. 0,2479 lít.
B. 0,4958 lít.
C. 0,5678 lít.
D. 1,487 lít.
Câu 27: Kim loại nào sau đây không tác dụng với dung dịch HCl?
A. Fe.
B. Na.
C. Ag.
D. Al.
Câu 28: Hydrogen halide có nhiệt độ sôi cao nhất là
A. HF.
B. HCl.
C. HBr.
D. HI.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Cho potassium iodide (KI) tác dụng với potassium permanganate (KMnO4) trong dung dịch sulfuric acid (H2SO4), thu được 3,02 g manganese(II) sulfate (MnSO4), I2 và K2SO4.
a) Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron, chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử.
b) Tính khối lượng potassium iodide (KI) đã tham gia phản ứng.
Câu 2 (1 điểm): Cho một lượng khí Cl2 vừa đủ vào dung dịch chứa 7,14 muối KX (X là một nguyên tố halogen) thu được 4,47 gam một muối duy nhất. Xác định muối KX.
Câu 3 (1 điểm): Bằng phương pháp hoá học hãy phân biệt các chất sau: HBr; NaI; KCl chứa trong các lọ riêng biệt, mất nhãn.
I. Trắc nghiệm
| 1 - C | 2 - B | 3 - C | 4 - D | 5 - C | 6 - D | 7 -D | 8 - A | 9 - B | 10 - D |
| 11 - C | 12 - A | 13 - A | 14 - B | 15 - B | 16 - B | 17 - C | 18 - B | 19 - B | 20 - D |
| 21 - B | 22 - A | 23 - C | 24 - B | 25 - A | 26 - B | 27 - C | 28 - A |
II. Tự luận
Câu 1:
![]() \(a) \mathrm{K}^{-1} \mathrm{I}+\mathrm{KM}^{+7} \mathrm{O}_4+\mathrm{H}_2 \mathrm{SO}_4 \rightarrow \stackrel{0}{\mathrm{I}}_2+\stackrel{+2}{\mathrm{Mn}} \mathrm{SO}_4+\mathrm{K}_2 \mathrm{SO}_4+\mathrm{H}_2 \mathrm{O}\)
\(a) \mathrm{K}^{-1} \mathrm{I}+\mathrm{KM}^{+7} \mathrm{O}_4+\mathrm{H}_2 \mathrm{SO}_4 \rightarrow \stackrel{0}{\mathrm{I}}_2+\stackrel{+2}{\mathrm{Mn}} \mathrm{SO}_4+\mathrm{K}_2 \mathrm{SO}_4+\mathrm{H}_2 \mathrm{O}\)
Chất khử: KI.
Chất oxi hoá: ![]() \(\mathrm{KMnO}_4.\)
\(\mathrm{KMnO}_4.\)
Quá trình khử: ![]() \(\stackrel{+7}{\mathrm{Mn}}+5 e \rightarrow \stackrel{+2}{M} n.\)
\(\stackrel{+7}{\mathrm{Mn}}+5 e \rightarrow \stackrel{+2}{M} n.\)
Quá trình oxi hoá: ![]() \(2 \stackrel{-1}{\mathrm{I}} \rightarrow \stackrel{0}{\mathrm{I}}_2+2 \mathrm{e}\)
\(2 \stackrel{-1}{\mathrm{I}} \rightarrow \stackrel{0}{\mathrm{I}}_2+2 \mathrm{e}\)
Phương trình hoá học được cân bằng:
![]() \(10 \mathrm{KI}+2 \mathrm{KMnO}_4+8 \mathrm{H}_2 \mathrm{SO}_4 \rightarrow 5 \mathrm{I}_2+2 \mathrm{MnSO} \mathrm{O}_4+6 \mathrm{KSO}_4+8 \mathrm{H}_2 \mathrm{O}\)
\(10 \mathrm{KI}+2 \mathrm{KMnO}_4+8 \mathrm{H}_2 \mathrm{SO}_4 \rightarrow 5 \mathrm{I}_2+2 \mathrm{MnSO} \mathrm{O}_4+6 \mathrm{KSO}_4+8 \mathrm{H}_2 \mathrm{O}\)
b) Ta có số mol manganese(II) sulfate = 0,02 mol
Khối lượng potassium iodide đã tham gia phản ứng: 0,1.166 = 16,6 g.
Câu 2:
 \(\begin{aligned}
& \mathrm{Cl}_2+2 \mathrm{KX} \rightarrow 2 \mathrm{KCl}+\mathrm{X}_2 \\
& n_{K X}=n_{K C l}=\frac{4,47}{74,5}=0,06(m o l) \\
& M_{K X}=\frac{7,14}{0,06}=119 \\
& \text { Vậy } \mathrm{M}_X=119-39=80 \text { nên KX là KBr. }
\end{aligned}\)
\(\begin{aligned}
& \mathrm{Cl}_2+2 \mathrm{KX} \rightarrow 2 \mathrm{KCl}+\mathrm{X}_2 \\
& n_{K X}=n_{K C l}=\frac{4,47}{74,5}=0,06(m o l) \\
& M_{K X}=\frac{7,14}{0,06}=119 \\
& \text { Vậy } \mathrm{M}_X=119-39=80 \text { nên KX là KBr. }
\end{aligned}\)
Câu 3:
Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Sử dụng quỳ tím làm thuốc thử.
+ Nếu quỳ tím chuyển sang màu đỏ → HBr.
+ Nếu quỳ tím không đổi màu → NaI; KCl (nhóm I).
- Phân biệt nhóm I bằng AgNO3.
+ Nếu có kết tủa trắng → KCl.
KCl + AgNO3 → AgCl + KNO3.
+ Nếu có kết tủa vàng → NaI.
NaI + AgNO3 → AgI + NaNO3.
|
SỞ GD&ĐT ……..
TRƯỜNG THPT…………….. (Đề thi gồm có 03 trang)
|
ĐỀ KIỂM TRA HỌC KỲ II NĂM HỌC 2023-2024 Môn: Hóa học 10 Thời gian làm bài: 60 phút, không kể thời gian giao đề |
Phần I: Trắc nghiệm (7 điểm)
Câu 1. Phát biểu nào sau đây là đúng?
A. Trong tất cả hợp chất, hydrogen luôn có số oxi hóa là +1
B. Trong tất cả các hợp chất, oxygen luôn có số oxi hóa là -2
C. Số oxi hóa của nguyên tử trong bất kì một đơn chất hóa học nào đều bằng 0
D. Tổng số oxi hóa của tất cả các nguyên tử trong một phân tử và trong một ion đa nguyên tử bằng 0.
Câu 2. Số oxi hóa của nitrogen trong ion là NO3
A. +3
B. +5
C. -3
D. -5
Câu 3. Trong các phản ứng hóa học sau, phản ứng oxi hóa – khử là
A. Ba(OH)2+ 2HCl→ BaCl2 + 2H2O
B. Fe3O4+ 8HCl →FeCl2 + 2FeCl3 + 4H2O
C. Cu + 2AgNO3→Cu(NO3)2 + 2Ag
D. FeCl2+ 2NaOH→ Fe(OH)2 + 2NaCl
Câu 4. Dẫn khí chlorine vào dung dịch KBr xảy ra phản ứng hóa học:
Cl2 + 2KBr→ 2KCl + Br2
Câu 8: Chất bị oxi hoá là
A. chất nhường electron
B. chất nhận electron.
C. chất có số oxi hoá giảm xuống sau phản ứng
D. chất có số oxi hoá không thay đổi sau phản ứng
Câu 9: Copper(II) oxide (CuO) bị khử bởi ammonia (NH3) theo phản ứng sau:
NH3+CuOt0→Cu+N2+H2ONH3+CuO→t0Cu+N2+H2O
Tổng hệ số cân bằng (tối giản) của phản ứng là?
A. 11.
B. 12
C. 13.
D. 14.
Câu 10: Nguyên tử carbon trong trường hợp nào sau đây vừa thể hiện tính khử, vừa thể hiện tính oxi hoá khi tham gia phản ứng hoá học?
A. C
B. CO2
C. CaCO3.
D. CH4.
Câu 11: Cho các phản ứng sau:
(a) 4HCl + PbO2 → PbCl2 + Cl2 + 2H2O (b) HCl + NH4HCO3 → NH4Cl + CO2 + H2O.
(c) 2HCl + 2HNO3 → 2NO2 + Cl2 + 2H2O (d) 2HCl + Zn → ZnCl2 + H2.
Số phản ứng trong đó HCl thể hiện tính khử là
A. 2.
B. 3
C. 1.
D. 4.
Câu 12: Cho 6,4 gram Cu tác dụng hết với lượng dư dung dịch H2SO4 đặc, nóng thu được V lít khí SO2 ở điều kiện chuẩn. Giá trị của V là
A. 4,958.
B.2,479
C. 3,720.
D. 0,297.
Câu 13: Cho đinh sắt vào ống nghiệm chứa 3 ml HCl, sắt phản ứng với HCl theo phương trình hoá học sau: Fe + 2HCl → FeCl2 + H2. Nhận xét nào sau đây là đúng?
A. Fe nhường electron nên là chất bị khử
B. Ion H+ nhận electron nên là chất oxi hoá.
C. Quá trình oxi hoá: H20+2e→H20
D. Quá trình khử: 0Fe→Fe+2+2e
Câu 14. Cho phản ứng: Br2(l) + HCOOH(aq) 2HBr(aq) + CO2(s) Nồng độ ban đầu của Br2 là aM, sau 50 giây nồng độ Br2 còn lại là 0,02M. Tốc độ trung bình của phản ứng trên là 4.10-5 M/s. Giá trị của a là
A. 0,02M
B. 0,07M
C. 0,02M
D. 0,022M
Câu 15. Việc làm nào dưới đây thể hiện sự ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng: CaCO3((s) + 2HCl(aq) CaCl2(aq) + CO2(g) + H2O(l)?
A. Pha loãng dung dịch HCl
B. Nghiền nhỏ đá vôi CaCO3
C. Sử dụng chất xúc tác
D. Tăng nhiệt độ của phản ứng
Câu 16. Cho các phát biểu sau:
(a) Khi đốt củi, nếu thêm một ít dầu hỏa lửa sẽ cháy to hơn. Như vậy, dầu hỏa đóng vai trò chất xúc tác cho quá trình này.
(b) Để thực phẩm tươi lâu, người ta dùng phương pháp bảo quản lạnh. Ở nhiệt độ thấp, quá trình phân hủy các chất diễn ra chậm hơn
(c) Trong quá trình làm sữa chua, lúc đầu người ta phải pha sữa trong nước ấm và thêm men là để tăng tốc độ quá trình gây chua. Sau đó làm lạnh để kìm hãm quá trình này
(d) Tùy theo phản ứng mà có thể dùng một, một số hoặc tất cả yếu tố để tăng tốc độ phản ứng
Số phát biểu sai là
A. 1
B. 2
C. 3
D. 4
Câu 17. Hệ số nhiệt độ Van’t Hoff được kí hiệu là
A. @
B.ϒ
C. φ
D. ∅
Câu 18. Cho phản ứng đơn giản xảy ra trong bình kín: H2(g) + Cl2(g) →2HCl(g)
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 giảm 4 lần và nồng độ Cl2 tăng 2 lần
A. tăng 4 lần
B. giảm 4 lần
C. giảm 2 lần
D. tăng 8 lần
Câu 19. Phản ứng giữa đơn chất halogen nào sau đây với hydrogen diễn ra mãnh liệt, nổ ngay cả trong bóng tối hoặc ở nhiệt độ thấp?
A. I2
B. Br2
C. Cl2
D. F2
Câu 20. Dung dịch Br2 có thể phản ứng được với dung dịch nào sau đây?
A. NaF
B. NaCl
C. NaBr
D. NaI
Câu 21. Trong công nghiệp, người ta sử dụng phản ứng giữa chlorine với dung dịch nào sau đây để tạo ra nước Javel có tính oxi hóa mạnh phục vụ cho mục đích sát khuẩn, vệ sinh gia dụng?
A. NaBr
B. NaOH
C. NaCl
D. MgCl2
Câu 22. Cấu hình electron lớp ngoài cùng của nguyên tố halogen là
A. ns2np3
B. ns2np4
C. ns2np5
D. ns2np6
Câu 23. Ở điều kiện thường, đơn chất chlorine có màu
A. lục nhạt
B. vàng lục
C. nâu đỏ
D. tím đen
Câu 24. Dung dịch chất nào sau đây được dùng để trung hòa môi trường base, hoặc thủy phân các chất trong quá trình sản xuất, tẩy rửa gỉ sắt (thành phần chính là các iron oxide) bám trên bề mặt của các loại thép?
A. H2SO4
B. HCl
C. NaOH
D. NaCl
Câu 25. Để phân biệt các dung dịch: NaF, NaCl, NaBr, NaI ta dùng
A. dung dịch HCl
B. quỳ tím
C. dung dịch BaCl2
D. dung dịch AgNO3
Câu 26. Hydrohalic acid có tính acid mạnh nhất là
A. Hydrochloric acid
B. Hydrofluoric acid
C. Hydrobromic acid
D. Hydroiodic acid
Câu 27. Phản ứng giữa chất nào sau đây với dung dịch H2SO4 đặc, nóng không phải là phản ứng oxi hóa – khử?
A. KBr(s)
B. KI(s)
C. NaCl(s)
D. NaBr(s)
Câu 28. Phản ứng hóa học nào sau đây là sai?
A. 2HCl + Fe →FeCl2+ H2
B. SiO2+ 4HF →SiF4 + 2H2O
C. Cl2+ 2NaBr →2NaCl + Br2
D. AgNO3+ HF →HNO3 + AgF
Phần II. Tự luận (3 điểm)
Câu 1 (1 điểm): Cho m gam KClO3 tác dụng với HCl đến khi phản ứng xảy ra hoàn toàn thấy thoát ra V lít khí Cl2 ở đktc. Biết lượng Cl2 sinh ra phản ứng vừa đủ với 0,56 gam Fe.
a) Viết các phương trình hóa học xảy ra, chỉ rõ chất khử, chất oxi hóa
b) Xác định m và V
Câu 2 (1 điểm): Viết các phương trình hóa học chứng minh tính oxi hóa giảm dần theo chiều: F2 > Cl2 > Br2 > I2
Câu 3 (1 điểm): Cho 2,24 gam hỗn hợp gồm: CaCO3 và Mg vào một lượng dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn thấy thoát ra 0,7437 lít hỗn hợp khí ở đkc. Xác định phần trăm khối lượng của các chất trong hỗn hợp ban đầu.
Phần I: Trắc nghiệm
|
1 - C |
2 - B |
3 - C |
4 - D |
5 - C |
6 - B |
7 - B |
8 – C |
9 - C |
10 - A |
|
11 - A |
12 - C |
13 - C |
14 - D |
15 - B |
16 - A |
17 - B |
18 - C |
19 - D |
20 - D |
|
21 - B |
22 - C |
23 - B |
24 - B |
25 - D |
26 - D |
27 - C |
28 - D |
||
Phần II; Tự luận
Xem đầy đủ đáp án trong file tải về
|
Số TT |
Nội dung kiến thức |
Đơn vị kiến thức |
Mức độ nhận thức |
Tổng số câu |
Tổng % điểm |
||||||||
|
Nhận biết |
Thông hiểu |
Vận dụng |
Vận dụng cao |
||||||||||
|
TN |
TL |
TN |
TL |
TN |
TL |
TN |
TL |
TN |
TL |
||||
|
1 |
Phản ứng oxi hóa khử |
Số oxi hóa |
1 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
2 |
1 |
20% |
|
Phản ứng oxi hóa – khử |
1 |
0 |
1 |
0 |
0 |
1 |
0 |
0 |
2 |
||||
|
2 |
Năng lượng hóa học |
Phản ứng hóa học và enthalpy |
2 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
3 |
0 |
15% |
|
Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học |
2 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
3 |
||||
|
3 |
Tốc độ phản ứng hóa học |
Tốc độ phản ứng hóa học |
4 |
0 |
4 |
0 |
0 |
0 |
0 |
0 |
8 |
0 |
20% |
|
4 |
Nguyên tố nhóm VIIA |
Nguyên tố và đơn chất halogen |
3 |
0 |
2 |
0 |
0 |
1 |
0 |
0 |
5 |
1 |
45% |
|
Hydrogen halide và hydrohalic acid |
3 |
0 |
2 |
0 |
0 |
0 |
0 |
1 |
5 |
1 |
|||
|
Tổng số câu |
16 |
0 |
12 |
0 |
0 |
2 |
0 |
1 |
28 |
3 |
|
||
|
Tỉ lệ % |
40% |
30% |
20% |
10% |
|
|
|
||||||
|
Tỉ lệ chung |
70% |
30% |
|
|
|
||||||||
BẢNG ĐẶC TẢ KĨ THUẬT ĐỀ THI HỌC KÌ 2
MÔN: HÓA HỌC 10 – CÁNH DIỀU
|
TT |
Nội dung kiến thức |
Đơn vị kiến thức |
Mức độ kiến thức, kĩ năng cần kiểm tra, đánh giá |
Số câu hỏi theo các mức độ nhận thức |
Tổng |
|||
|
NB |
TH |
VD |
VCD |
|||||
|
1 |
Phản ứng oxi hóa – khử |
Số oxi hóa |
Nhận biết: Số oxi hóa của nguyên tố trong đơn chất, hợp chất Thông hiểu: Xác định được số oxi hóa của nguyên tố trong một số hợp chất cụ thể |
1 |
1 |
|
|
2 |
|
Phản ứng oxi hóa – khử |
Nhận biết: Khái niệm chất oxi hóa, chất khử, sự oxi hóa, sự khử Thông hiểu: Xác định được chất oxi hóa, chất khử, quá trình oxi hóa, quá trình khử trong phản ứng oxi hóa khử Vận dụng: Lập được phương trình hóa học của một số phản ứng oxi hóa – khử |
1 |
1 |
1 |
|
3 |
||
|
2 |
Năng lượng hóa học |
Phản ứng hóa học và enthalpy |
Nhận biết: - Dự đoán các phản ứng hóa học là phản ứng tỏa nhiệt hay thu nhiệt - Trình bày được khái niệm phản ứng tỏa nhiệt, thu nhiệt, điều kiện chuẩn Thông hiểu: Đếm số phát biểu đúng sai liên quan đến biến thiên enthalpy |
2 |
1 |
|
|
3 |
|
Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học |
Nhận biết: - Nêu được ý nghĩa của dấu và giá trị - Dựa vào nhiệt phản ứng xác định phản ứng là tỏa nhiệt hay thu nhiệt. Thông hiểu: Đếm số phát biểu đúng sai liên quan đến ý nghĩa biến thiên enthalpy |
2 |
1 |
|
|
3 |
||
|
3 |
Tốc độ phản ứng hóa học |
Tốc độ phản ứng hóa học |
Nhận biết: - Trình bày được khái niệm tốc độ phản ứng hóa học và cách tính tốc độ trung bình của phản ứng. - Viết được biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng và nồng độ. - Nêu được ý nghĩa của hệ số nhiệt đới Van’t Hoff () Thông hiểu: - Giải thích được các yếu tố ảnh hưởng tới tốc độ phản ứng như: nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác. - Tính được tốc độ trung bình của một phản ứng hóa học - Vận dụng được kiến thức tốc độ phản ứng hóa học vào việc giải thích một số vấn đề trong cuộc sống và sản xuất. |
4 |
4 |
|
|
8 |
|
4 |
Nguyên tố nhóm VIIA |
Nguyên tố và đơn chất halogen |
Nhận biết: - Phát biểu được trạng thái tự nhiên của các nguyên tố halogen - Chỉ ra được trạng thái, màu sắc, nhiệt độ nóng chảy, nhiệt độ sôi của các đơn chất halogen. - Chỉ ra được hiện tượng của các thí nghiệm so sánh tính oxi hóa của các halogen Thông hiểu - Viết sản phẩm phản ứng thể hiện tính chất của đơn chất halogen - Tính thể tích khí chlorine (ở đktc) tạo thành trong phản ứng đơn giản - So sánh được tính oxi hóa giữa các halogen Vận dụng: Bài tập liên quan đến tính chất hóa học của các đơn chất halogen |
3 |
2 |
1
|
|
6 |
|
Hydrogen halide và hydrohalic acid |
Nhận biết: - Trình bày được xu hướng biến đổi tính acid của dãy hydrohalic acid. - Chỉ ra được hiện tượng của phản ứng khi cho dung dịch AgNO3 tác dụng với ion X- - Nêu được ứng dụng của một số hydrogen halide Thông hiểu: - Tính được khối lượng kim loại trong phản ứng đơn giản có HCl tham gia - Viết được PTHH thể hiện tính chất hóa học của các acid HX. Vận dụng cao: Vận dụng giải bài tập liên quan đến hydrohalic acid, ion halide X |
3 |
2 |
|
1 |
6 |
||
|
Tổng |
|
16 |
12 |
2 |
1 |
31 |
||
|
Tỉ lệ % từng mức độ nhận thức |
|
40% |
30% |
20% |
10% |
100% |
||
|
Tỉ lệ chung |
|
70% |
30% |
|
||||
............
Tải file tài liệu để xem thêm đề thi học kì 2 Hóa học 10
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây: