Hỗ trợ tư vấn
Tư vấn - Giải đáp - Hỗ trợ đặt tài liệu
Tài liệu cao cấp không áp dụng tải nhanh miễn phí cho thành viên gói Pro.
Tìm hiểu thêm »Đề thi giữa kì 1 Khoa học tự nhiên 9 Cánh diều năm 2025 - 2026 gồm 3 đề có đáp án giải chi tiết kèm theo. Qua đề kiểm tra Khoa học tự nhiên 9 Cánh diều giữa học kì 1 giúp các bạn học sinh ôn luyện củng cố kiến thức để biết cách ôn tập đạt kết quả cao.
TOP 3 Đề kiểm tra giữa kì 1 Khoa học tự nhiên 9 Cánh diều năm 2025 được biên soạn dưới dạng file Word với cấu trúc mới theo Công văn 7991. Hi vọng qua đề kiểm tra giữa kì 1 Khoa học tự nhiên 9 Cánh diều sẽ giúp các em học sinh nắm vững kiến thức, kỹ năng toán học đã học trong nửa đầu học kì, làm quen với áp lực thời gian, cách phân bổ thời gian hợp lý, trình bày bài thi rõ ràng, mạch lạc. Ngoài ra các bạn xem thêm đề thi giữa kì 1 GDCD 9 Cánh diều.
Lưu ý: Bộ đề thi giữa kì 1 Khoa học tự nhiên 9 Cánh diều được biên soạn với cấu trúc như sau. Tùy theo yêu cầu của từng Sở mà thầy cô ra đề cho các em nhé.
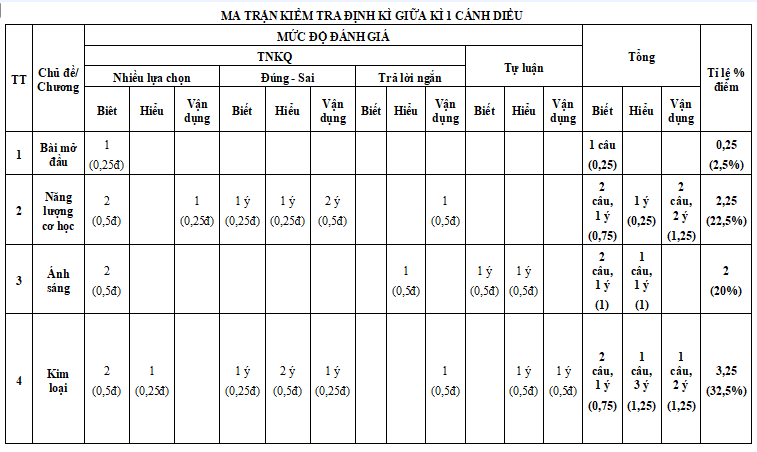
............
Xem đầy đủ nội dung đề thi trong file tải về
|
SỞ GD& ĐT ………. TRƯỜNG THCS…….
(Đề kiểm tra gồm 4 trang) |
ĐỀ KIỂM TRA GIỮA HỌC KỲ I NĂM HỌC 2025-2026 MÔN: KHOA HỌC TỰ NHIÊN 9 Thời gian làm bài: ….phút (không kể thời gian phát đề) |
PHẦN I. CÂU TRẮC NGHIỆM PHƯƠNG ÁN NHIỀU LỰA CHỌN.
Thí sinh trả lời từ câu 1 đến câu 12. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: Dụng cụ nào sau đây dùng để phân tán nhiệt khi đốt?
A. Lưới tản nhiệt.
B. Bát sứ.
C. Bình cầu.
D. Phếu chiết.
Câu 2: Chiều xoắn của phân tử DNA là
A. chiều từ phải qua trái.
B. chiều từ trái sang phải.
C. cùng với chiều di chuyển của kim đồng hồ.
D. xoắn theo mọi chiều khác nhau.
Câu 3: Một tia sáng phát ra từ một bóng đèn trong một bể cá cảnh, chiếu lên trên, xiên góc vào mặt nước và ló ra ngoài không khí thì góc khúc xạ sẽ
A. lớn hơn góc tới.
B. bằng góc tới.
C. nhỏ hơn góc tới.
D. đạt cực đại
Câu 4: Nếu chọn mặt đất làm mốc để tính thế năng thì trong các vật, vật nào sau đây không có thế năng?
A. Viên đạn đang bay.
B. Lò xo để tự nhiên ở một độ cao so với mặt đất.
C. Hòn bi đang lăn trên mặt đất.
D. Lò xo bị ép đặt ngay trên mặt đất.
Câu 5: Hai vật có khối lượng là m và 2m đặt ở hai độ cao lần lượt là 2h và h. Thế năng hấp dẫn của vật thức nhất so với vật thứ hai là
A. bằng hai lần vật thứ hai.
B. bằng vật thứ hai.
C. bằng một nửa vật thứ hai.
D. bằng một phần tư vật thứ hai.
Câu 6: Kim loại cứng nhất, được pha trộn cùng sắt để tạo ra thép không gỉ là
A. Au.
B. Ag.
C. Cr.
D. Al.
Câu 7: Chiếu một chùm sáng song song tới lăng kính. Tăng dần góc tới i từ giá trị nhỏ nhất thì
A. góc lệch D tăng theo i.
B. góc lệch D giảm dần.
C. góc lệch D tăng tới một giá trị xác định rồi giảm dần.
D. góc lệch D giảm tới một giá trị rồi tăng dần.
Câu 8: Trong các trường hợp sau đây trường hợp có công cơ học?
A. Có lực tác dụng vào vật làm cho vật chuyển dời theo phương của lực tác dụng.
B. Có lực tác dụng vào vật làm cho vật chuyển dời theo phương vuông góc với phương của lực tác dụng.
C. Có lực tác dụng vào vật.
D. Có lực tác dụng vào vật nhưng vật không chuyển động.
Câu 9: Kim loại nào dưới đây không phản ứng với nước ở điều kiện thường?
A. K.
B. Na.
C. Ca.
D. Fe.
..............
PHẦN II. TRẮC NGHIỆM ĐÚNG SAI (2 điểm)
Câu 13: Trong quá trình chuyển động, động năng và thế năng của vật có thể chuyển đổi qua lại lẫn nhau. Theo lý thuyết, các phát biểu dưới đây đúng hay sai?
a) Khi một vật được ném lên cao, động năng chuyển hóa thành thế năng.
b) Khi một vật rơi từ trên cao xuống, thế năng giảm dần và động năng tăng dần.
c) Trong thực tế, để giảm mất mát năng lượng, chúng ta cần thiết kế các vật thể có hình dạng khí động học.
d) Cơ năng của một vật luôn giảm nếu không có lực cản.
Câu 14: Khi cho Na, Mg, Fe tác dụng với nước, các nhận định nhận định sau đúng hay sai?
a) Na phản ứng mạnh, có khí thoát ra.
b) Mg phản ứng mạnh ở điều kiện thường.
c) Fe không phản ứng với nước ở nhiệt độ thường.
d) Tất cả đều tạo ra hydroxide và H2.
PHẦN III. TRẢ LỜI NGẮN (2 điểm)
Câu 15: Một gene dài 4080 Å, số lượng nucleotide của gene đó là bao nhiêu?
.........
Đề thi vẫn còn mời các bạn xem đầy đủ trong file tải về
Nội dung đáp án đề thi trong file tải về
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây:
Bộ đề thi giữa học kì 1 môn Khoa học tự nhiên 9 năm 2025 - 2026 sách Cánh diều
Bộ đề thi giữa học kì 1 môn Khoa học tự nhiên 9 năm 2025 - 2026 sách Cánh diều
99.000đ