Hỗ trợ tư vấn
Tư vấn - Giải đáp - Hỗ trợ đặt tài liệu
Mua gói Pro để tải file trên Download.vn (không bao gồm tài liệu cao cấp) và trải nghiệm website không quảng cáo
Tìm hiểu thêm »Giải bài tập KHTN 9 Bài 15: Tính chất chung của kim loại giúp các em học sinh trả lời các câu hỏi trong SGK Khoa học tự nhiên 9 Cánh diều trang 77, 78, 79, 80, 81, 82.
Giải Khoa học tự nhiên 9 Bài 15 được biên soạn bám sát theo chương trình SGK. Đồng thời, cũng giúp thầy cô tham khảo để soạn giáo án Bài 15 Chủ đề 6: Kim loại - Phần 2: Chất và sự biến đổi của chất cho học sinh của mình. Vậy mời thầy cô và các em cùng theo dõi nội dung chi tiết trong bài viết dưới đây của Download.vn:
Các vật dụng trong hình 15.1 được chế tạo dựa trên tính chất vật lí nào của kim loại?

Trả lời:
Các vật dụng trong hình 15.1 được chế tạo dựa trên tính dẻo của kim loại.
Cụ thể: Kim loại có tính dẻo nên có thể rèn, kéo dài thành sợi hoặc dát mỏng. Dựa trên tính chất này, kim loại được dùng để tạo nên các đồ vật khác nhau như hộp đựng thức ăn bằng nhôm, giấy nhôm bọc thực phẩm, dây đồng, …
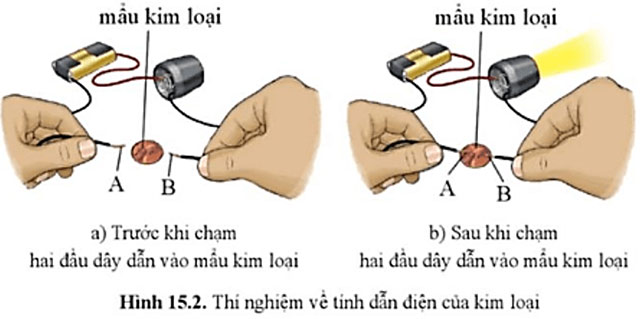
Quan sát hình 15.2 nêu hiện tượng trước và sau khi chạm hai đầu dây dẫn A và B vào mẩu kim loại. Giải thích.
Trả lời:
Hiện tượng:
- Trước khi chạm hai đầu dây dẫn vào mẩu kim loại, đèn không sáng.
- Sau khi chạm hai đầu dây dẫn vào mẩu kim loại, đèn sáng.
Giải thích: Do kim loại có tính dẫn điện.
Quan sát đồ trang sức được làm bằng vàng, bạc (hình 15.5), em hãy cho biết màu sắc và vẻ sáng của chúng

Trả lời:
Vòng tay được làm bằng vàng có màu vàng, trên bề mặt có vẻ sáng lấp lánh.
Vòng tay được làm bằng bạc có màu trắng, trên bền mặt có vẻ sáng lấp lánh.
Viết các phương trình hóa học minh hoạ một số tính chất hoá học của kim loại mà em đã biết.
Trả lời:
Một số tính chất hoá học của kim loại mà em đã biết:
- Nhiều kim loại tác dụng với oxygen tạo thành oxide. Ví dụ:
3Fe + 2O2 ![]() \(\overset{to}{\rightarrow}\) Fe3O4
\(\overset{to}{\rightarrow}\) Fe3O4
- Nhiều kim loại tác dụng với phi kim tạo thành muối. Ví dụ:
2Fe + 3Cl2 ![]() \(\overset{to}{\rightarrow}\) 2FeCl3
\(\overset{to}{\rightarrow}\) 2FeCl3
- Nhiều kim loại tác dụng với acid (HCl, H2SO4 loãng …) tạo thành muối và giải phóng khí hydrogen. Ví dụ:
Fe + 2HCl → FeCl2 + H2
- Một số kim loại đẩy được kim loại đứng sau ra khỏi muối. Ví dụ:
Fe + CuSO4→ FeSO4 + Cu
- Một số kim loại tác dụng được với nước ở nhiệt độ thường tạo thành hydroxide và khí hydrogen. Ví dụ:
2Na + 2H2O → 2NaOH + H2
Quan sát hình 15.6 và cho biết khả năng phản ứng của natri với khí chlorine (b) như thế nào.

Trả lời:
Natri (sodium) nóng chảy phản ứng mãnh liệt với khí chlorine để tạo thành muối.
2Na + Cl2 ![]() \(\overset{to}{\rightarrow}\) 2NaCl
\(\overset{to}{\rightarrow}\) 2NaCl
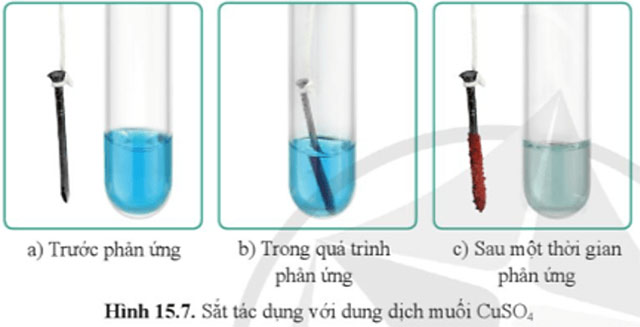
Quan sát hình 15.7, cho biết trước, trong và sau một thời gian phản ứng, màu của dung dịch CuSO4 và đinh sắt thay đổi như thế nào. Giải thích.
Trả lời:
|
Trước phản ứng |
Trong phản ứng |
Sau phản ứng |
|
|
Dung dịch CuSO4 |
Màu xanh |
Màu xanh nhạt dần |
Màu xanh nhạt |
|
Đinh sắt |
Màu xám trắng |
Có lớp kim loại màu đỏ bám dần vào bề mặt đinh sắt |
Có lớp kim loại màu đỏ bám ngoài bề mặt đinh sắt (phần nhúng vào dung dịch) |
Giải thích: Fe tác dụng với dung dịch CuSO4 tạo thành muối FeSO4 (làm dung dịch nhạt màu so với ban đầu) và Cu (bám ngoài đinh sắt).
Fe + CuSO4 → FeSO4 + Cu
So sánh sự khác biệt về tính chất vật lí, tính chất hoá học và một số ứng dụng quan trọng của nhôm, sắt, vàng.
Trả lời:
- Khác biệt trong tính chất vật lí:
|
Kim loại Al |
Kim loại Fe |
Kim loại Au |
|
|
Tính chất vật lí chung |
- Là kim loại có màu trắng bạc, khá mềm, dẫn nhiệt, dẫn điện tốt và nhẹ. |
- Có màu trắng hơi xám, có tính dẻo, có độ cứng cao và có tính nhiễm từ. |
- Là kim loại có tính dẻo, tính dẫn điện, dẫn nhiệt tốt, có màu vàng lấp lánh. |
|
Khối lượng riêng (g/cm3) |
2,70 |
7,87 |
19,29 |
|
Nhiệt độ nóng chảy (oC) |
660 |
1 535 |
1 065 |
- Khác biệt trong tính chất hoá học:
|
Kim loại Al |
Kim loại Fe |
Kim loại Au |
|
|
Tác dụng với O2 |
Phản ứng tạo thành oxide kim loại (oxide lưỡng tính). 4Al + 3O2 |
Phản ứng tạo thành oxide kim loại (oxide base). 3Fe + 2O2 |
Không phản ứng |
|
Tác dụng với HCl |
Phản ứng tạo thành muối và giải phóng H2. 2Al + 6HCl → 2AlCl3 + 3H2 |
Phản ứng tạo thành muối và giải phóng H2. Fe + 2HCl → FeCl2 + H2 |
Không phản ứng |
- Ứng dụng quan trọng:
|
Kim loại Al |
Kim loại Fe |
Kim loại Au |
|
Nhôm thường được sử dụng làm dây dẫn điện và là nguyên liệu để sản xuất các vật dụng như khung cửa, vách ngăn, khung máy, … |
Sắt có nhiều ứng dụng trong đời sống và sản xuất, là thành phần chủ yếu trong gang và thép. |
Vàng được sử dụng làm đồ trang sức, một số chi tiết của vi mạch điện tử,.. |
Dự đoán khả năng dẫn nhiệt của các kim loại Cu, Al, Fe và Ag theo chiều giảm dần.
Trả lời:
Kim loại dẫn điện tốt thường cũng dẫn nhiệt tốt.
Khả năng dẫn điện của các kim loại giảm dần theo thứ tự: Ag, Cu, Al, Fe.
Dự đoán khả năng dẫn nhiệt của các kim loại cũng giảm dần theo thứ tự: Ag, Cu, Al, Fe.
Thuỷ ngân dễ bay hơi và rất độc. Nếu chẳng may nhiệt kế thủy ngân bị vỡ thì có thể dùng bột lưu huỳnh rắc lên thuỷ ngân vì thuỷ ngân tác dụng với lưu huỳnh tạo thành chất mới không bay hơi và dễ thu gom hơn. Viết phương trình hoá học của phản ứng xảy ra.
Trả lời:
Phương trình hoá học:
Hg + S → HgS
Viết phương trình hoá học của phản ứng xảy ra khi cho Zn tác dụng với O2, dung dịch H2SO4 loãng và dung dịch muối CuSO4
Trả lời:
Phương trình hoá học:
2Zn + O2 → 2ZnO
Zn + H2SO4loãng → ZnSO4 + H2
Zn + CuSO4 → ZnSO4 + Cu
Giải thích vì sao thực phẩm có vị chua không nên đựng trong đồ dùng bằng kim loại mà nên đựng trong đồ dùng bằng thuỷ tinh, sành hoặc sứ.
Trả lời:
Vị chua của thực phẩm thường được gây ra bởi các acid. Không nên đựng thực phẩm có vị chua trong đồ dùng bằng kim loại do acid trong thực phẩm có thể tác dụng với kim loại trong vật đựng làm thực phẩm nhiễm độc kim loại, ảnh hưởng đến sức khoẻ người sử dụng.
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây: