Hỗ trợ tư vấn
Tư vấn - Giải đáp - Hỗ trợ đặt tài liệu
Mua gói Pro để tải file trên Download.vn và trải nghiệm website không quảng cáo
Tìm hiểu thêm »Giải bài tập KHTN 9 Bài 28: Tinh bột và cellulose giúp các em học sinh nhanh chóng trả lời các câu hỏi thảo luận, luyện tập trong SGK Khoa học tự nhiên 9 Chân trời sáng tạo trang 121, 122, 123, 124.
Giải Khoa học tự nhiên 9 Bài 28 được biên soạn bám sát theo chương trình SGK. Đồng thời, cũng giúp thầy cô tham khảo để soạn giáo án Bài 28 - Chủ đề 9: Lipid - Carbohydrate - Protein, Polymer cho học sinh của mình. Mời thầy cô và các em cùng theo dõi nội dung chi tiết trong bài viết dưới đây của Download.vn:
Liệt kê một số sản phẩm nông nghiệp có chứa tinh bột.
Trả lời:
Một số sản phẩm nông nghiệp có chứa tinh bột là gạo, ngô, khoai, sắn, …
Hãy kể tên một số loại thực vật có chứa nhiều cellulose.
Trả lời:
Một số loại thực vật có chứa nhiều cellulose là cây tre, cây nứa, cây bông, cây đay, …
Hãy nêu nhận xét về trạng thái, màu sắc, khả năng tan trong nước của tinh bột và cellulose.
Trả lời:
Ở điều kiện thường, tinh bột và cellulose đều là chất rắn, màu trắng. Tinh bột có hình dạng không xác định, không tan trong nước lạnh nhưng tan được một phần trong nước nóng; cellulose có dạng sợi và không tan trong nước.
Hãy cho nhận xét về khối lượng phân tử của tinh bột và cellulose.
Trả lời:
Khối lượng phân tử của tinh bột và cellulose đều rất lớn, trong đó khối lượng phân tử của cellulose lớn hơn so với tinh bột.
Quan sát Thí nghiệm 1 và nêu hiện tượng xảy ra.
Thí nghiệm 1: Tinh bột phản ứng với iodine
Dụng cụ và hóa chất: ống nghiệm, hồ tinh bột, dung dịch iodine.
Tiến hành thí nghiệm:
Bước 1: Cho khoảng 3mL hồ tinh bột vào ống nghiệm sạch.
Bước 2: Thêm tiếp vài giọt dung dịch iodine vào ống nghiệm và quan sát.
Trả lời:
Hiện tượng: xuất hiện màu xanh tím.
Quan sát Thí nghiệm 2 và nêu hiện tượng xảy ra.
Thí nghiệm 2: Thuỷ phân tinh bột
Dụng cụ và hoá chất: ống nghiệm, dung dịch hồ tinh bột, dung dịch iodine, dung dịch HCl 2 M.
Tiến hành thí nghiệm:
Bước 1: Cho 50 mL nước vào cốc thuỷ tinh và đun sôi trên ngọn lửa đèn cồn.
Bước 2: Cho khoảng 3 mL dung dịch hồ tinh bột vào ống nghiệm, rồi thêm tiếp khoảng 1 mL dung dịch HCl 2 M. Sau đó đặt ống nghiệm vào cốc nước sôi và đun tiếp khoảng 10 phút.
Bước 3: Lấy ống nghiệm ra, để nguội rồi nhỏ vài giọt dung dịch iodine.
Trả lời:
Sau phản ứng ta thấy dung dịch trở nên trong hơn do hồ tinh bột đã bị thủy phân tạo ra đường glucose tan được trong nước.
Lấy ống nghiệm ra, để nguội rồi nhỏ vài giọt dung dịch iodine không thấy xuất hiện màu xanh tím.
Phương trình hóa học:
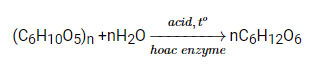
Hãy liệt kê một số ứng dụng của tinh bột và cellulose trong đời sống mà em biết.
Trả lời:
- Tinh bột là nguồn cung cấp lương thực chính cho con người và nhiều loại động vật; trong công nghiệp, nó được dùng để sản xuất ethylic alcohol, ...
- Cellulose có nhiều ứng dụng trong đời sống: sản xuất giấy, vật liệu xây dựng (gỗ), sản xuất vải sợi, ...
Theo em, quá trình quang hợp có vai trò quan trọng như thế nào?
Trả lời:
Quá trình quang hợp ở cây xanh có vai trò vô cùng quan trọng đối với sự sống. Nhờ quá trình quang hợp, hằng năm cây cối trên Trái Đất hấp thụ và đồng hoá được hàng chục tỉ tấn carbon ở dạng carbon dioxide, đồng thời giải phóng vào khí quyển một lượng khổng lồ khí oxygen cần thiết cho sự sống trên Trái Đất.
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây: