Hỗ trợ tư vấn
Tư vấn - Giải đáp - Hỗ trợ đặt tài liệu
Mua gói Pro để tải file trên Download.vn (không bao gồm tài liệu cao cấp) và trải nghiệm website không quảng cáo
Tìm hiểu thêm »Giải KHTN 9 Bài 21: Sự khác nhau cơ bản giữa phi kim và kim loại giúp các em học sinh lớp 9 tham khảo để nhanh chóng trả lời các câu hỏi trong sách Khoa học tự nhiên 9 Kết nối tri thức với cuộc sống trang 100, 101, 102.
Qua đó, cũng giúp thầy cô tham khảo để soạn giáo án Bài 21 Chương VI: Kim loại, sự khác nhau cơ bản giữa phi kim và kim loại SGK Khoa học tự nhiên 9 Kết nối tri thức với cuộc sống cho học sinh của mình theo chương trình mới. Vậy mời thầy cô và các em cùng theo dõi nội dung chi tiết trong bài viết dưới đây của Download.vn:
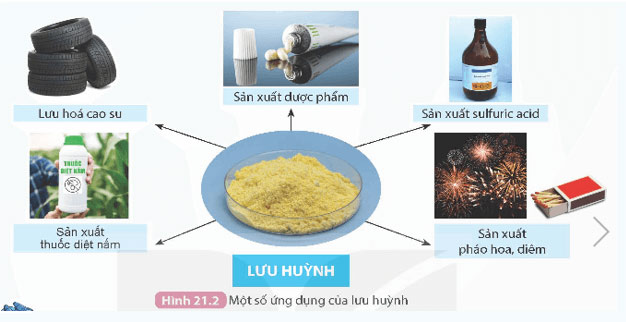
Hoạt động: Sử dụng Hình 21.2, kết hợp với những hiểu biết của em trong thực tế, em hãy trình bày một số ứng dụng của các phi kim như carbon, lưu huỳnh, chlorine trong cuộc sống.
Trả lời:
* Ứng dụng của carbon: Carbon có nhiều ứng dụng như: carbon ở dạng than hoạt tính được sử dụng trong mặt nạ phòng độc, chất khử màu, khử mùi; than cốc dùng làm nhiên liệu, nguyên liệu trong công nghiệp luyện kim, …; than chì dùng làm điện cực, chất bôi trơn, ruột bút chì, …; kim cương dùng làm đồ trang sức, mũi khoan, dao cắt kính, …
* Ứng dụng của lưu huỳnh: Lưu huỳnh có nhiều ứng dụng như: lưu hoá cao su, sản xuất dược phẩm, sản xuất sulfuric acid, sản xuất thuốc diệt nấm, sản xuất pháo hoa, sản xuất diêm …
*Ứng dụng của chlorine: Chlorine có nhiều ứng dụng trong cuộc sống và trong các ngành công nghiệp như khử trùng nước sinh hoạt; sản xuất nước Javel, chất tẩy rửa,… tẩy trắng vải, sợi, bột giấy, … sản xuất chất dẻo, …
Câu hỏi 1: Giải thích tại sao trong phản ứng giữa kim loại và phi kim, phi kim thường nhận electron.
Trả lời:
Các nguyên tử kim loại thường có 1, 2, 3 electron ở lớp ngoài cùng còn các nguyên tử phi kim thường có 5, 6, 7 electron ở lớp ngoài cùng.
Để đạt trạng thái bền vững giống các khí hiếm gần nhất (với 8 electron ở lớp ngoài cùng hoặc 2 electron ở lớp ngoài cùng giống He) các nguyên tử kim loại khi tham gia phản ứng hoá học có xu hướng cho electron để tạo thành các ion dương; trong khi đó, các nguyên tử phi kim khi tác dụng với kim loại lại có xu hướng nhận electron để tạo thành các ion âm.
Câu hỏi 2: Lấy ví dụ minh hoạ sự khác nhau giữa kim loại và phi kim về tính chất vật lí và tính chất hoá học.
Trả lời:
* Sự khác nhau về tính chất vật lí:
- Trong khi các kim loại dẫn điện tốt thì phi kim thường không dẫn điện.
Ví dụ: Các phi kim thường không dẫn điện, silicon tinh khiết là chất bán dẫn, than chì có tính dẫn điện nhưng yếu hơn kim loại.
- Phần lớn các phi kim có nhiệt độ nóng chảy, nhiệt độ sôi thấp hơn kim loại.
Ví dụ:
|
Đơn chất phi kim |
Nhiệt độ nóng chảy (oC) |
Nhiệt độ sôi (oC) |
Đơn chất kim loại |
Nhiệt độ nóng chảy (oC) |
Nhiệt độ sôi (oC) |
|
Oxygen |
-218,4 |
-183,0 |
Nhôm |
660,3 |
2 518,0 |
|
Chlorine |
-101,5 |
-34,7 |
Sắt |
1 535,0 |
2 861,0 |
|
Lưu huỳnh |
106,8 |
444,7 |
Đồng |
1 084,6 |
2 561,5 |
- Phần lớn các phi kim có khối lượng riêng nhỏ hơn kim loại.
Ví dụ:
- Khối lượng riêng của lưu huỳnh là 2,07 gam/cm3; khối lượng riêng của phosphorus là 1,82 gam/cm3.
- Khối lượng riêng của kim loại sắt là 7,87 gam/cm3; khối lượng riêng của kim loại vàng là 19,29 gam/cm3.
* Sự khác nhau về tính chất hoá học:
- Trong phản ứng hoá học, các kim loại dễ nhường electron để tạo ra ion dương, còn các phi kim dễ nhận electron để tạo ion âm.
Ví dụ: Trong phản ứng giữa Na và Cl2 tạo NaCl:
Na → Na+ + 1e;
Cl + 1e → Cl−
- Kim loại tác dụng với oxygen thường tạo thành oxide base, trong khi đó phi kim tác dụng với oxygen thường tạo thành oxide acid.
Ví dụ:
S + O2 → SO2 (oxide acid)
2Cu + O2 → 2CuO (oxide base)
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây: