Hỗ trợ tư vấn
Tư vấn - Giải đáp - Hỗ trợ đặt tài liệu
Mua gói Pro để tải file trên Download.vn (không bao gồm tài liệu cao cấp) và trải nghiệm website không quảng cáo
Tìm hiểu thêm »Giải bài tập Khoa học tự nhiên 7 Bài 2: Nguyên tử hay nhất, ngắn gọn giúp các em học sinh dễ dàng làm bài tập trong SGK Khoa học tự nhiên 7 Kết nối tri thức với cuộc sống trang 14, 15, 16, 17, 18.
Qua đó, các em dễ dàng nêu được cấu tạo hạt nguyên tử, vỏ nguyên tử, khối lượng nguyên tử. Đồng thời, cũng giúp thầy cô tham khảo soạn giáo án Bài 2 Chương I: Nguyên tử - Sơ lược về bảng tuần hoàn các nguyên tố hóa học cho học sinh của mình. Vậy mời thầy cô và các em cùng theo dõi bài viết dưới đây của Download.vn:
Mọi vật thể tự nhiên hay nhân tạo đều được tạo thành từ một số loại hạt vô cùng nhỏ bé gọi là nguyên tử. Vậy nguyên tử có cấu tạo như thế nào?
Trả lời:
- Nguyên tử có kích thước vô cùng nhỏ, cấu tạo rỗng.
- Gồm 3 hạt:
Theo Đê – mô – crit và Đan – tơn, nguyên tử được quan niệm như thế nào?
Trả lời:
Theo Đê – mô – crit: Nguyên tử là một loại hạt vô cùng nhỏ, tạo nên sự đa dạng của vạn vật. Nguyên tử là loại hạt nhỏ nhất của một vật
Theo Đan – tơn: Tồn tại các đơn vị chất tối thiểu (được gọi là nguyên tử) để chúng kết hợp vừa đủ với nhau.
Hoạt động:
Làm mô hình nguyên tử carbon theo Bo
Chuẩn bị: bìa carton, giấy màu vàng, các viên bi nhựa to màu đỏ và các viên bi nhỏ màu xanh.
Tiến hành:
Gắn viên bi đỏ vào bìa carton làm hạt nhân nguyên tử carbon. Cắt giấy màu vàng thành hai đường tròn có bán kính khác nhau và mỗi vòng tròn có độ dày khoảng 1 cm (Hình 2.3).
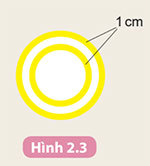
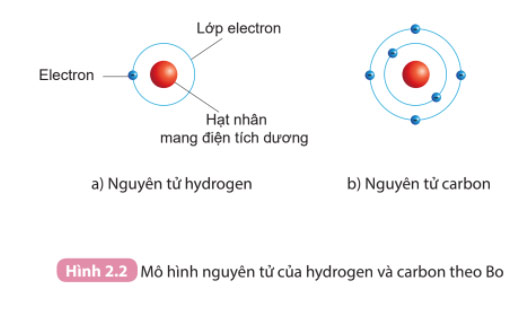
Dán các đường tròn lên bìa carton sao cho tâm của hai đường tròn là viên bi đỏ. Gắn các viên bi màu xanh lên hai đường tròn màu vàng như Hình 2.2b.
Thảo luận nhóm và trả lời câu hỏi:
1. Các đường tròn bằng giấy màu vàng biểu diễn gì?
2. Em hãy cho biết số electron có trong lớp electron thứ nhất và thứ hai của nguyên tử carbon và chỉ ra lớp electron đã chứa tối đa electron
Trả lời:
1. Các đường tròn bằng giấy màu vàng biểu diễn lớp electron của nguyên tử
2. Quan sát mô hình nguyên tử carbon, nhận thấy:
=> Lớp thứ nhất đã chứa tối đa electron (2 electron)
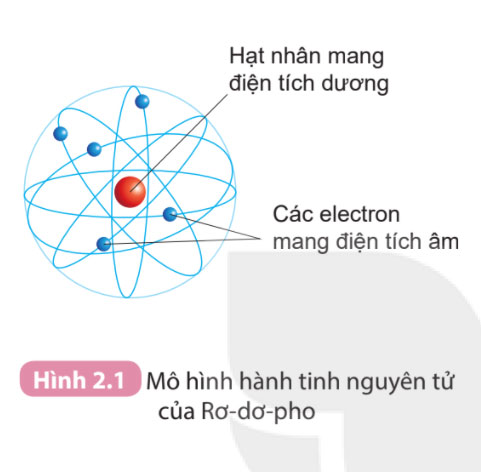
Câu 1. Quan sát Hình 2.1 và cho biết các thành phần cấu tạo nên nguyên tử.
Trả lời:
Dựa vào Hình 2.1, thành phần cấu tạo nên nguyên tử gồm:
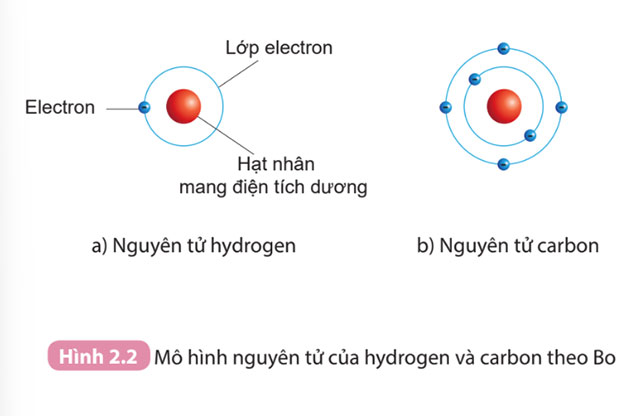
Câu 2. Quan sát Hình 2.2, áp dụng mô hình nguyên tử của Bo, mô tả cấu tạo của nguyên tử hydrogen và nguyên tử carbon
Trả lời:
Áp dụng mô hình nguyên tử của Bo
- Nguyên tử hydrogen:
- Nguyên tử carbon:
Quan sát Hình 2.4 và cho biết:
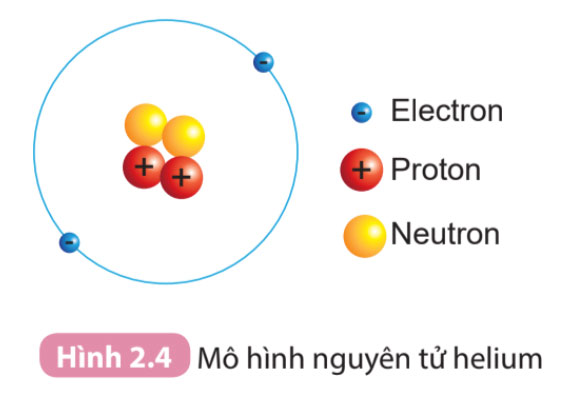
1. Hạt nhân nguyên tử có một hay nhiều hạt? Các hạt đó thuộc cùng một loại hạt hay nhiều loại hạt?
2. Số đơn vị điện tích hạt nhân của helium bằng bao nhiêu?
Trả lời:
1. Quan sát Hình 2.4:
2. Số đơn vị điện tích hạt nhân (Z) bằng tổng số hạt proton trong hạt nhân
Trong Hình 2.4, Helium có 2 proton (hạt màu đỏ)
=> Số đơn vị điện tích hạt nhân của helium là: Z = 2
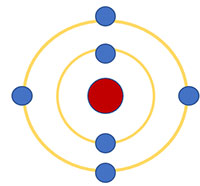
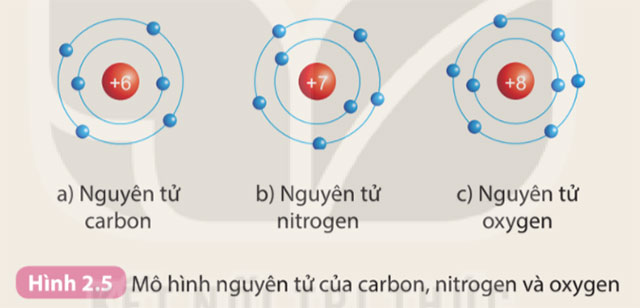
Quan sát Hình 2.6 và cho biết:
1. Thứ tự sắp xếp các electron ở vỏ nguyên tử chlorine
2. Số electron trên từng lớp ở vỏ nguyên tử chlorine
Trả lời:
1. Các electron sắp xếp thành từng lớp theo thứ tự từ trong ra ngoài: Lớp thứ nhất (lớp trong cùng) → Lớp thứ 2 → Lớp thứ 3
2. Số electron trên từng lớp ở vỏ nguyên tử chlorine:
Câu 1. Em hãy cho biết vì sao khối lượng hạt nhân nguyên tử có thể coi là khối lượng của nguyên tử.
Trả lời:
Ta có:
=> Khối lượng electron nhỏ hơn rất nhiều so với khối lượng proton và neutron
=> Có thể bỏ qua khối lượng của electron hay khối lượng hạt nhân nguyên tử có thể coi là khối lượng của nguyên tử
- Ví dụ: Xét nguyên tử helium có 2p, 2n và 2e
Câu 2. Hãy so sánh khối lượng của nguyên tử nhôm (13p, 14n) và nguyên tử đồng (29p, 36n).
Trả lời:
Ở câu hỏi 1 ta biết rằng khối lượng hạt nhân nguyên tử có thể coi là khối lượng của nguyên tử
Khối lượng hạt nhân nguyên tử bằng tổng khối lượng của các hạt proton, neutron trong hạt nhân
Mà: Khối lượng 1 proton = 1 neutron = 1amu
=> Khối lượng nguyên tử nhôm (13p, 14n) = 13.1 + 14.1 = 27 amu
Khối lượng nguyên tử đồng (29p, 36n) = 29.1 + 36.1 = 65 amu

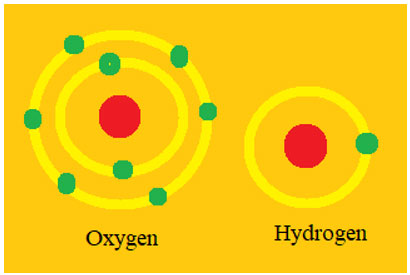
Làm được mô hình một số nguyên tử theo mô hình nguyên tử của Bo.
Trả lời:
Làm mô hình nguyên tử hydrogen, oxygen theo mô hình nguyên tử của Bo.
Chuẩn bị: 2 tấm bìa carton, giấy màu vàng, các viên bị nhựa to màu đỏ (2 viên) và các viên bi nhỏ màu xanh (9 viên).
Tiến hành:
- Gắn hai viên bi đỏ vào giữa hai tấm bìa carton làm hạt nhân nguyên tử.
- Cắt giấy màu vàng thành 2 đường tròn có độ dày 1 cm, bán kính 3 cm và 1 đường tròn có độ dày 1cm, bán kính 4 cm.
- Dán giấy vàng vào tấm bìa carton, tấm 1 dán 1 vòng nhỏ; tấm 2 dán 1 vòng nhỏ + 1 vòng lớn sao cho tâm của đường tròn là viên bi đỏ.
- Gắn các viên bi xanh lên đường tròn màu vàng như hình bên dưới.
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây: