Hỗ trợ tư vấn
Tư vấn - Giải đáp - Hỗ trợ đặt tài liệu
Mua gói Pro để tải file trên Download.vn (không bao gồm tài liệu cao cấp) và trải nghiệm website không quảng cáo
Tìm hiểu thêm »Giải bài tập SGK Hóa học 12 trang 70, 71, 72, 73, 74 sách Chân trời sáng tạo giúp các em học sinh lớp 12 xem gợi ý giải các câu hỏi Bài 13: Điện phân thuộc Chương 5: Pin điện và điện phân.
Soạn Hóa 12 Chân trời sáng tạo Bài 13 các em sẽ biết cách trả lời toàn bộ các câu hỏi bài học này. Đồng thời, qua tài liệu này giúp quý thầy cô tham khảo để soạn giáo án cho học sinh của mình theo chương trình mới. Mời thầy cô và các em cùng theo dõi bài viết dưới đây của Download.vn:
Viết phương trình hoá học của quá trình điện phân nóng chảy các chất: MgCl2, Al2O3.
Lời giải:
Phương trình hoá học:

Viết quá trình xảy ra ở mỗi điện cực và phương trình hoá học của phản ứng điện phân khi điện phân dung dịch AgNO3; CuCl2 với điện cực graphite.
Lời giải:
* Điện phân dung dịch AgNO3:
Tại anode (cực dương): 2H2O → O2 + 4H+ + 4e
Tại cathode (cực âm): Ag+ + 1e → Ag
Phương trình hoá học của phản ứng điện phân:

* Điện phân dung dịch CuCl2:
Tại anode (cực dương): 2Cl− → Cl2 + 2e
Tại cathode (cực âm): Cu2+ + 2e → Cu
Phương trình hoá học của phản ứng điện phân:

Điện phân CaCl2 nóng chảy, ở cathode xảy ra quá trình nào?
A. Oxi hoá ion Ca2+.
B. Khử ion Ca2+.
C. Oxi hoá ion Cl−.
D. Khử ion Cl−.
Lời giải:
Đáp án đúng là: B
Điện phân dung dịch Cu(NO3)2 với điện cực trơ, ở anode xảy ra quá trình nào?

Lời giải:
Đáp án đúng là: A
Viết phương trình hoá học của phản ứng điện phân khi điện phân KCl nóng chảy.
Lời giải:
Phương trình hoá học:
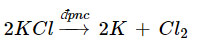
Hãy đề xuất và trình bày cách mạ đồng (Cu) lên một đồ vật làm từ sắt (Fe) bằng phương pháp điện phân.
Lời giải:
Mạ đồng (Cu) lên một đồ vật làm từ sắt (Fe) bằng phương pháp điện phân với anode làm bằng đồng và cathode là vật bằng sắt cần được mạ và cùng được nhúng trong dung dịch Cu2+ (dung dịch muối của đồng, ví dụ CuSO4).
- Ở anode: Cu → Cu2+ + 2e (điện cực đồng tan ra).
- Ở cathode: Cu2+ + 2e → Cu (đồng sinh ra bám vào vật cần mạ).
Hai quá trình này giữ cho nồng độ CuSO4 trong bình điện phân không đổi.
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây: