Hỗ trợ tư vấn
Tư vấn - Giải đáp - Hỗ trợ đặt tài liệu
Mua gói Pro để tải file trên Download.vn (không bao gồm tài liệu cao cấp) và trải nghiệm website không quảng cáo
Tìm hiểu thêm »Giải Hóa 10 Bài 9: Liên kết ion sách Chân trời sáng tạo là tài liệu vô cùng hữu ích, giúp các em học sinh lớp 10 có thêm nhiều gợi ý tham khảo, nhanh chóng trả lời toàn bộ câu hỏi trong sách giáo khoa trang 55→ 58 thuộc chương 3: Liên kết hóa học.
Hóa 10 bài 9 Liên kết ion được biên soạn khoa học, chi tiết giúp các em rèn kỹ năng giải Hóa, so sánh đáp án vô cùng thuận tiện từ đó sẽ học tốt môn Hóa học 10. Đồng thời đây cũng là tài liệu giúp quý thầy cô tham khảo để soạn giáo án. Vậy sau đây là giải Hóa 10 bài 9 trang 55 sách Chân trời sáng tạo, mời các bạn cùng theo dõi tại đây.
Ion Mg2+ có cấu hình electron giống cấu hình electron của khí hiếm nào?
|
A. Helium |
B. Neon |
C. Argon |
D. Krypton |
Gợi ý đáp án
Đáp án B
Cấu hình electron của nguyên tử Mg (Z = 12): 1s22s22p63s2
Nguyên tử Mg nhường 2 electron tạo thành ion Mg2+ có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
Cho các ion sau: Ca2+, F-, Al3+ và N3-. Số ion có cấu hình electron của khí hiếm neon là
| A. 4 | B. 2 | C. 1 | D. 3 |
Gợi ý đáp án
Đáp án D
- Cấu hình electron của nguyên tử Ca (Z = 20): 1s22s22p63s23p64s2
Nguyên tử Ca nhường 2 electron tạo thành ion Ca2+ có cấu hình electron là:
1s22s22p6 3s23p6 giống với cấu hình electron của khí hiếm Ar.
- Cấu hình electron của nguyên tử F (Z = 9): 1s22s22p5
Nguyên tử F nhận 1 electron tạo thành ion F- có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
Cấu hình electron của nguyên tử Al (Z = 13): 1s22s22p63s23p1
Nguyên tử Al nhường 3 electron tạo thành ion Al3+ có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
- Cấu hình electron của nguyên tử N (Z = 7): 1s22s22p3
Nguyên tử N nhận 3 electron tạo thành ion N3- có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
Vậy có 3 ion là F-, Al3+ và N3- có cấu hình electron giống với cấu hình electron của khí hiếm Ne.
Potassium và magnesium là các nguyên tố thiết yếu đối với cơ thể sinh vật sống.
a) Viết cấu hình electron của các ion được tạo thành từ nguyên tử của các nguyên tố này. Chúng có cấu hình electron của những nguyên tử khí hiếm nào?
b) Có hợp chất ion nào chỉ tạo bởi các ion trên với nhau không? Vì sao?
Gợi ý đáp án
a)
Potassium (K, Z = 19) có cấu hình electron là: 1s22s22p63s23p64s1
Nguyên tử K nhường 1 electron tạo thành ion K+ có cấu hình electron là: 1s22s22p63s23p6giống với cấu hình electron của khí hiếm Ar.
Cấu hình electron của nguyên tử Mg (Z = 12): 1s22s22p63s2
Nguyên tử Mg nhường 2 electron tạo thành ion Mg2+ có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
b) Không có hợp chất ion nào chỉ tạo bởi các ion K+ và Mg2+ với nhau vì hai ion này cùng mang điện tích dương. Hợp chất ion chỉ được tạo bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Hoàn thành những thông tin còn thiếu trong bảng sau:
| Công thức hợp chất ion | Cation | Anion |
| CaF2 | ? | ? |
| ? | K+ | O2- |
Gợi ý đáp án
| Công thức hợp chất ion | Cation | Anion |
| CaF2 | Ca2+ | F- |
| K2O | K+ | O2- |
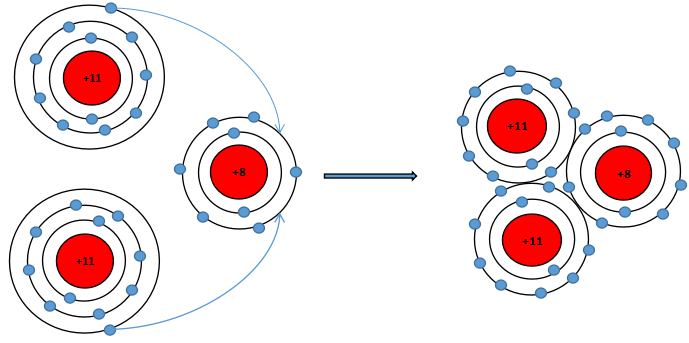
Sodium oxide (Na2O) có trong thành phần thủy tinh và các sản phẩm gốm sứ. Trình bày sự hình thành liên kết ion trong phân tử sodium oxide.
Gợi ý đáp án
Nguyên tử Na (Z = 11): 1s22s22p63s1 ⇒ Có 1 electron ở lớp ngoài cùng
⇒ Có xu hướng nhường 1 electron để đạt cấu hình electron của khí hiếm tạo thành ion Na+
- Nguyên tử O (Z = 8): 1s22s22p4 ⇒ Có 6 electron ở lớp ngoài cùng
⇒ Có xu hướng nhận 2 electron để đạt cấu hình electron của khí hiếm tạo thành ion O2-
⇒ Nguyên tử O nhận 2 electron của hai nguyên tử Na tạo thành ion là O2-.
- Hai ion Na + và 1 ion O2- liên kết với nhau tạo thành phân tử Na2O
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây: