Hỗ trợ tư vấn
Tư vấn - Giải đáp - Hỗ trợ đặt tài liệu
Mua gói Pro để tải file trên Download.vn (không bao gồm tài liệu cao cấp) và trải nghiệm website không quảng cáo
Tìm hiểu thêm »Đối với dạng toán này nếu giải theo thứ tự, khả năng xuầt hiện rất phức tạp để đơn giản ta dùng:
Định luật bảo toàn electron:
Nguyên tắc của phương pháp :” Khi có nhiều chất oxi hóa hoặc chất khử trong hỗn hợp phản ứng (nhiều phản ứng hoặc phản ứng qua nhiều giai đoạn) thì tổng số mol electron mà các phân tử chất khử cho phải bằng tổng số mol electron mà các chất oxi hóa nhận”.
Điều quan trọng khi áp dụng phương pháp này là nhận định đúng trạng thái đầu và cuối của các chất oxi hóa khử.
VD: Cho hỗn hợp Mg và Zn tác dụng với dung dịch chứa Cu(NO3)2 và AgNO3. Nếu sau phản ứng thu được hỗn hợp 3 kim loại thì 3 kim loại này chỉ có thể là: Cu, Ag, Zn (còn nguyên hoặc dư). Do Zn còn nên AgNO3 và Cu(NO3)2 đều đã phản ứng hết.
Gọi a, b lần lượt là số mol Mg, Zn ban đầu, c là số mol Zn còn dư.
x, y là số mol AgNO3, Cu(NO3)2 đã dùng, ta có các quá trình cho và nhận electron như sau:
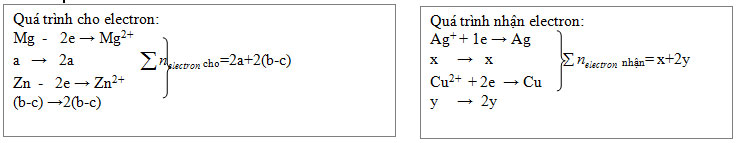
Áp dụng định luật bảo toàn electron ta có: 2a +2(b-c) = x + 2y
Ví dụ: Cho m (g) hỗn hợp Y gồm 2,8g Fe và 0,81g Al vào 200ml dd C chứa AgNO3 và Cu(NO3)2. Khi phản ứng kết thúc được dd D và 8,12g rắn E gồm 3 kim loại. Cho rắn E tác dụng với dd HCl dư thì được 0,672 lít H2(đktc). Tính nồng độ mol các chất trong dung dịch C.
A. [AgNO3]=0,15M, [Cu(NO3)2]=0,25M B. [AgNO3]=0,1M, [Cu(NO3)2]=0,2M
C. [AgNO3]=0,5M, [Cu(NO3)2]=0,5M D. [AgNO3]=0,05M, [Cu(NO3)2]=0,05M
Câu 1: Hòa tan hoàn toàn 19,2g kim loại M trong dung dịch HNO3 dư thu được 8,96lít(đktc) hỗn hợp khí gồm NO2 và NO có tỉ lệ thể tích 3:1. Xác định kim loại M.
A. Fe(56) B. Cu(64) C. Al(27) D. Zn(65)
Câu 2: Hòa tan hoàn toàn 11,2g Fe vào HNO3 dư thu được dung dịch A và 6,72 lít hỗn hợp khí B gồm NO và một khí X, với tỉ lệ thể tích là 1:1. Xác định khí X?
A. NO B. N2O C. NO2 D. D. N2
Câu 3: Khi cho 1,92g hỗn hợp X gồm Mg và Fe có tỉ lệ mol 1:3 tác dụng hoàn toàn với HNO3 tạo ra hỗn hợp khí gồm NO và NO2 có thể tích 1,736 lít (đktc). Tính khối lượng muối tạo thành và số mol HNO3 đã phản ứng.
A. 8,074gam và 0,018mol B. D. 8,4gam và 0,8mol
C. 8,7gam và 0,1mol D. 8,74gam và 0,1875mol
Câu 4: Cho 3g hỗn hợp gồm Cu, Ag tan hết trong dung dịch gồm HNO3 và H2SO4 thu 2,94g hỗn hợp 2 khí NO2 và SO2 có thể tích 1,344lít (đktc). Tính % khối lượng mỗi kim loại?
A. 60% và 40% B. 65% và 35% C. 64% và 36% D. 40% và 60%
Download file tài liệu để xem thêm chi tiết
Theo Nghị định 147/2024/ND-CP, bạn cần xác thực tài khoản trước khi sử dụng tính năng này. Chúng tôi sẽ gửi mã xác thực qua SMS hoặc Zalo tới số điện thoại mà bạn nhập dưới đây: