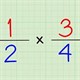
Lê Phạm Thành – Cử nhân Chất Lượng Cao Hóa Học – ðHSP Hà Nội Nhận gia sư môn Hóa Học
Copyright © 2007 Lê Phạm Thành E-mail: thanh.lepham@gmail.com
Phone: 0976053496
Trang 1
CHƯƠNG I. CÁC PHƯƠNG PHÁP GIÚP
GIẢI NHANH BÀI TOÁN HÓA HỌC
“Phương pháp là Thầy của các Thầy”
(Talley Rand
Talley RandTalley Rand
Talley Rand)
§
§§
§1
11
1.
. .
. PHƯƠNG PHÁP SƠ Đ
PHƯƠNG PHÁP SƠ ĐPHƯƠNG PHÁP SƠ Đ
PHƯƠNG PHÁP SƠ ĐỒ
ỒỒ
Ồ
ĐƯ
ĐƯĐƯ
ĐƯỜ
ỜỜ
ỜNG CHÉO
NG CHÉONG CHÉO
NG CHÉO
Với hình thức thi trắc nghiệm khách quan, trong một khoảng thời gian tương ñối ngắn học sinh phải
giải quyết một số lượng câu hỏi và bài tập khá lớn (trong ñó bài tập toán chiếm một tỉ lệ không nhỏ). Do
ñó việc tìm ra các phương pháp giúp giải nhanh bài toán hóa học có một ý nghĩa quan trọng.
Bài toán trộn lẫn các chất với nhau là một dạng bài hay gặp trong chương trình hóa học phổ thông.
Ta có thể giải bài tập dạng này theo nhiều cách khác nhau, song cách giải nhanh nhất là “phương pháp
sơ ñồ ñường chéo”.
Nguyên tắc: Trộn lẫn 2 dung dịch:
Dung dịch 1: có khối lượng m
1
, thể tích V
1
, nồng ñộ C
1
(C% hoặc C
M
), khối lượng riêng d
1
.
Dung dịch 2: có khối lượng m
2
, thể tích V
2
, nồng ñộ C
2
(C
2
> C
1
), khối lượng riêng d
2
.
Dung dịch thu ñược có m = m
1
+ m
2
, V = V
1
+ V
2
, nồng ñộ C (C
1
< C < C
2
), khối lượng riêng d.
Sơ ñồ ñường chéo và công thức tương ứng với mỗi trường hợp là:
a) ðối với nồng ñộ % về khối lượng:
m
1
C
1
|C
2
- C|
C
m
2
C
2
|C
1
- C|
→
(1)
|CC|
| CC |
m
m
1
2
2
1
−
=
b)
ðố
i v
ớ
i n
ồ
ng
ñộ
mol/lít:
V
1
C
1
|C
2
- C|
C
V
2
C
2
|C
1
- C|
→
(2)
|CC|
| CC |
V
V
1
2
2
1
−
=
c)
ðố
i v
ớ
i kh
ố
i l
ượ
ng riêng:
V
1
d
1
|d
2
- d|
d
V
2
d
2
|d
1
- d|
→
(3)
|dd|
| dd |
V
V
1
2
2
1
−
=
Khi s
ử
d
ụ
ng s
ơ
ñồ
ñườ
ng chéo ta c
ầ
n chú ý:
*) Ch
ấ
t r
ắ
n coi nh
ư
dung d
ị
ch có C = 100%
*) Dung môi coi nh
ư
dung d
ị
ch có C = 0%
*) Kh
ố
i l
ượ
ng riêng c
ủ
a H
2
O là d = 1 g/ml
Sau ñây là một số ví dụ sử dụng phương pháp ñường chéo trong tính toán pha chế dung dịch.
Dạng 1: Tính toán pha chế dung dịch
Ví dụ 1. ðể
thu
ñượ
c dung d
ị
ch HCl 25% c
ầ
n l
ấ
y m
1
gam dung d
ị
ch HCl 45% pha v
ớ
i m
2
gam dung
d
ị
ch HCl 15%. T
ỉ
l
ệ
m
1
/m
2
là:
Hướng dẫn giải:
Áp d
ụ
ng công th
ứ
c (1):
1
2
10
20
|5215|
| 5245 |
m
m
2
1
==
−
=
⇒
ð
áp án C.
Ví dụ 2. ðể
pha
ñượ
c 500 ml dung d
ị
ch n
ướ
c mu
ố
i sinh lí (C = 0,9%) c
ầ
n l
ấ
y
V
ml dung d
ị
ch NaCl
3%. Giá tr
ị
c
ủ
a
V
là:
A. 150 B. 214,3 C. 285,7 D. 350